
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Идеальные газы
|
|
|
|
Уравнения состояния реального газа
Законы и уравнение состояния идеальных газов.
Идеальными называются газы, у которых молекулы представляют собой материальные точки и между молекулами отсутствуют силы взаимодействия.
При относительно низком давлении и высоких температурах реальные газы имеют малую плотность и, с известным допущением, могут рассматриваться как газы идеальные.
Законы идеальных газов были установлены в XVII - XIX столетиях исследователями, изучавшими экспериментальным путем поведение газов при давлениях, близких к атмосферному.
Закон Бойля (1662 г.) – Мариотта (1676 г.): произведение абсолютного давления на удельный объем идеального газа при неизменной температуре есть величина постоянная, т.е. произведение абсолютного давления на удельный объем идеального газа зависит только от температуры газа:
при t = idem рv= idem. (24)
Закон Гей Люссака ( 1802 г. ) – относительное расширение идеальных газов при неизменном давлении (p=idem) пропорционально повышению температуры
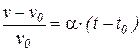 , (25)
, (25)
при 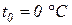
 ;
; 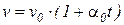 , (26)
, (26)
где v – удельный объем газа при температуре t и давлении p; v0 – удельный объем газа при температуре t 0 = 0 0C;  – температурный коэффициент объемного расширения идеальных газов при t0 = 0 0C, сохраняющий одно и то же значение при всех давлениях и одинаковый для всех идеальных газов.
– температурный коэффициент объемного расширения идеальных газов при t0 = 0 0C, сохраняющий одно и то же значение при всех давлениях и одинаковый для всех идеальных газов.
Из сопоставления этих законов выводится уравнение состояния идеальных газов - уравнение Клапейрона (1834 г.):
для 1 кг газа 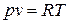 ; (27)
; (27)
для 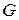 кг газа
кг газа  , (28)
, (28)
где 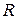 – характеристическая постоянная газа; Т – абсолютная температура газа
– характеристическая постоянная газа; Т – абсолютная температура газа
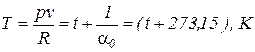 . (29)
. (29)
Продифференцировав уравнение Клапейрона при постоянном давлении, получим: 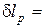
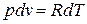 .
.
Отсюда
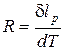 . (30)
. (30)
Это значит, что характеристическая газовая постоянная (R) – это термодинамическая работа 1 кг газа в изобарном процессе (p = idem) при изменении температуры газа на один градус.
Закон Авогадро ( 1811 г. ) – объем одного киломоля идеального газа не зависит от его природы и вполне определяется параметрами состояния газа  .
.
Молярный объем идеального газа с использованием уравнения Клапейрона определяется из соотношения
 , (31)
, (31)
где 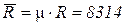 Дж/(кмоль×К) – универсальная газовая постоянная.
Дж/(кмоль×К) – универсальная газовая постоянная.
Уравнения состояния для 1 кмоля и для  кмолей идеального газа имеют следующий вид:
кмолей идеального газа имеют следующий вид:
для 1 кмоля газа  ; (32)
; (32)
для  кмолей газа
кмолей газа  . (32а)
. (32а)
Эти уравнения называются уравнениями Клапейрона – Менделеева.
Закон Джоуля определяет, что внутренняя энергия идеального газа зависит только от температуры
 ;
; 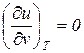 . (33)
. (33)
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 906; Нарушение авторских прав?; Мы поможем в написании вашей работы!