
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Майера. Энтропия идеального газа
|
|
|
|
Первое начало термодинамики для идеальных газов.
Идеальные газы подчиняются уравнению состояния Клапейрона  и закону Джоуля, согласно которому удельная внутренняя энергия идеального газа зависит только от температуры
и закону Джоуля, согласно которому удельная внутренняя энергия идеального газа зависит только от температуры
 . (64)
. (64)
Совместное использование уравнения Клапейрона и закона Джоуля приводит к выводу о том, что удельная энтальпия идеального газа также являются функциями только температуры
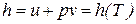 . (65)
. (65)
С учетом законов идеальных газов и исходя из соотношений (55), (56), изменение внутренней энергии 1 кг идеального газа в элементарном и конечном (1-2) процессах находится по следующим формулам:
 ;
;  , (66)
, (66)
а изменение энтальпии 1 кг идеального газа в элементарном и конечном (1-2) процессах определяется по следующим зависимостям:
 ;
;  . (67)
. (67)
После подстановки соотношений (66) и (67) в выражение первого начала термодинамики для простых тел (48), (49) получаем уравнение первого начала термодинамики для идеального газа по балансу рабочего тела в дифференциальной и интегральной формах:
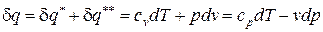 ; (68)
; (68)
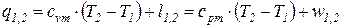 . . (69)
. . (69)
Из уравнения первого начала термодинамики для идеального газа (68) можно получить следующее выражение:
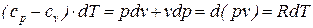 , (70)
, (70)
из которого следует, что разность истинных теплоемкостей идеального газа при постоянном давлении и при постоянном объеме равна величине характеристической газовой постоянной
 . (71)
. (71)
Это выражение (71) впервые было получено Р. Майером (1842 г.) и называется законом Майера.
Уравнение (71) может быть записано и для одного кмоля газа
 . (72)
. (72)
Разделив уравнение (68) на абсолютную температуру T, получим
 . (73)
. (73)
С учетом того, что для идеального газа, исходя из уравнения Клапейрона, справедливы равенства:  ;
; 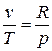 получим
получим
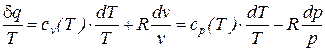 . (74)
. (74)
Правая часть уравнения (74) представляет собой сумму полных дифференциалов. Это значит, что и соотношение 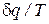 есть полный дифференциал некоторой функции состояния идеального газа(s), называемой удельной энтропией.
есть полный дифференциал некоторой функции состояния идеального газа(s), называемой удельной энтропией.
Изменение удельной энтропии в элементарном процессе представляет собой полный дифференциал и определяется соотношением
 . (75)
. (75)
Из уравнения (74) после интегрирования получим, что изменение удельной энтропии идеального газа в процессе (1-2) может быть найдено из соотношения
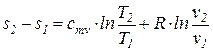 =
=  . (76)
. (76)
Теплоемкости  и
и  называются вторыми средними теплоемкостями и находятся путем осреднения по логарифму абсолютных температур
называются вторыми средними теплоемкостями и находятся путем осреднения по логарифму абсолютных температур
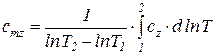 . (77)
. (77)
Если принять, что истинная теплоемкость является линейной функцией температуры  , то
, то
 . (78)
. (78)
Таким образом, первая средняя теплоемкость равна истинной теплоемкости при средней арифметической температуре процесса (Tma), а вторая – при средней логарифмической температуре процесса (Tmz). В случае, если 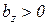 , то первая средняя теплоемкость численно несколько больше второй.
, то первая средняя теплоемкость численно несколько больше второй.
5. Процессы изменения состояния термодинамических систем
Классификация термодинамических процессов
Термодинамический процесс может быть задан либо графическим способом в виде изображения процесса в координатах p-v, p-T, Т-s, либо в аналитической форме в виде зависимости 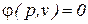 .
.
Уравнение процесса может быть также задано исходным условием о неизменном значении в этом процессе какой - либо функции состояния ( ) или условием о равенстве нулю какого – либо эффекта термодинамического процесса
) или условием о равенстве нулю какого – либо эффекта термодинамического процесса  , однако и в этом случае исходное условие приводится к основной форме уравнения процесса.
, однако и в этом случае исходное условие приводится к основной форме уравнения процесса.
При изучении термодинамических процессов определяются:
1) закономерность изменения параметров состояния рабочего тела, то есть выводится уравнение процесса или дается его графическое изображение в координатах p-v, p-T, Т-s и т.д.;
2) параметры состояния системы в начальной и конечной точках процесса;
3) численные значения работы и теплообмена в процессе;
4) изменение значений внутренней энергии, энтальпии и энтропии рабочего тела.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 2010; Нарушение авторских прав?; Мы поможем в написании вашей работы!