
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аналитическое выражение первого начала термодинамики
|
|
|
|
Значения удельных внутренней энергии и энтальпии простого тела однозначно определяются двумя независимыми переменными и могут быть представлены следующим образом:
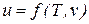 ; (53)
; (53)
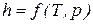 . (54)
. (54)
Изменения внутренней энергии и энтальпии простого тела, как функций состояния, в элементарных процессах являются полными дифференциалами и определяются соотношениями
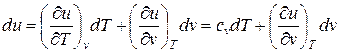 ; (55)
; (55)
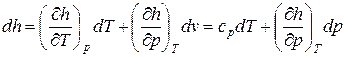 . (56)
. (56)
Соотношения (55) и (56) получены, исходя из анализа зависимостей (19), (48), который показывает, что для изохорного процесса (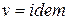 ) частная производная внутренней энергии по температуре равна истинной изохорной теплоемкости
) частная производная внутренней энергии по температуре равна истинной изохорной теплоемкости
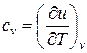 , (57)
, (57)
а для изобарного процесса (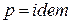 ) частная производная энтальпии по температуре равна истинной изобарной теплоемкости
) частная производная энтальпии по температуре равна истинной изобарной теплоемкости
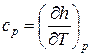 . (58)
. (58)
В результате подстановки выражений (55) и (56) в уравнение (48) и разделения переменных получим:
 . (59)
. (59)
Данное соотношение (59) называется первым началом термодинамики для простых тел в аналитической форме.
Выражения в квадратных скобках уравнения (59) в литературе часто называют калорическими коэффициентами, которые могут быть определены по формулам, полученным с использованием дифференциальных соотношений термодинамики,
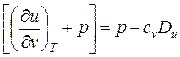 , (60)
, (60)
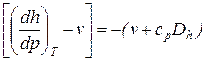 , (61)
, (61)
где 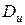 – коэффициент Джоуля – Гей Люссака,
– коэффициент Джоуля – Гей Люссака,
 ; (62)
; (62)
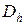 – коэффициент Джоуля-Томсона,
– коэффициент Джоуля-Томсона,
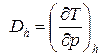 . (63)
. (63)
Коэффициенты Джоуля – Гей Люссака (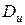 ) и Джоуля-Томсона (
) и Джоуля-Томсона (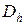 ) реальных газов определяются по таблицам термодинамических свойств, представленным в справочной литературе.
) реальных газов определяются по таблицам термодинамических свойств, представленным в справочной литературе.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 762; Нарушение авторских прав?; Мы поможем в написании вашей работы!