
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплообмен в термодинамических процессах простых тел
|
|
|
|
Теплообмен в любом термодинамическом процессе изменения состояния простых тел может быть выражен в зависимости от величины термодинамической или потенциальной работы процесса. При этом термодинамический процесс в общем случае рассматривается как политропа с переменным показателем.
Расчетное выражения теплообмена для простых тел выводится на основе рассмотрения выражения первого начала термодинамики
 (109)
(109)
Удельная внутренняя энергия для простых тел может быть представлена в виде функции любых двух независимых параметров состояния. Примем, что u =и (p, v). Тогда дифференциал внутренней энергии запишется в следующем виде:
 . (110)
. (110)
Последнее выражение (110) можно представить в виде
 . (111)
. (111)
Введем следующие обозначения:
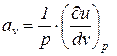 ;
;  . (112)
. (112)
При этом выражение (111) примет вид:
 . (113)
. (113)
Сопоставляя соотношения (109) и (113), получим
 (114)
(114)
Для определения величин ( и
и  ) рассмотрим два термодинамических процесса:
) рассмотрим два термодинамических процесса:
1. Изоэнергетический процесс (u = idem, du = 0). Для этого процесса показатель политропы принимает значение n = nu.
Так как в изоэнергетическом процессе  , из уравнения (113) следует, что
, из уравнения (113) следует, что
 (115)
(115)
или
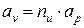 . (115а)
. (115а)
2. Адиабатный процесс(d q = 0). В этом процессе показатель политропы принимает значение n = k и называется показателем адиабаты.
В адиабатном процессе элементарная термодинамическая работа также не равна нулю, поэтому из выражения (114) имеем
 . (116)
. (116)
Сопоставляя соотношения (115) и (116), получаем следующие выражения:
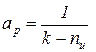 ,
,  . (117)
. (117)
С учетом полученных соотношений для определения av и ap, находим выражения для расчета удельных значений изменения внутренней энергии и теплообмена в элементарном процессе:
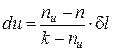 , (118)
, (118)
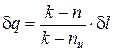 . (119)
. (119)
Соотношения для расчета удельных значений изменения внутренней энергии и теплообмена в конечном процессе имеют следующий вид:
 , (120)
, (120)
 . (121)
. (121)
Полученные соотношения (120), (121) позволяют в координатах p - v построить области подвода и отвода теплоты (рис. 9).

|
Некоторые характеристики важнейших термодинамических процессов приведены в табл. 1
Таблица 1
Термодинамические процессы изменения состояния простого тела
| Название и уравнение процесса | Показатель политропы | Графическое изображение | Работа | Количество теплоты |
| Политропный pvn = idem | -¥ £ n £ +¥,
n = 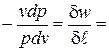

| 
| l1,2 =  ,
w1,2 = n ,
w1,2 = n  ,
t 1,2 = ,
t 1,2 =  = =  =
= =
=  = = 
| q1,2 = Du1,2 + l1,2 =
= Dh1,2 + w1,2,
q1,2 = 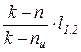
|
| Изобарный p = idem, dp = 0 | n = 0 |

| l1,2= p×(v2 - v1),
w1,2= 0,
t 1,2 = 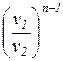 = = 
| q1,2 = Du1,2 + l1,2 = = Dh1,2 |
Продолжение табл. 1
| Изохорный v = idem, dv = 0 | n = ± ∞ | 
| l1,2 = 0,
w1,2 = v×(p1 - p2),
t 1,2 =  = = 
| q1,2 = Du1,2 = = Dh1,2 + w1,2 |
| Изопотенциаль-ный pv = idem | n = 1 | 
|
l1,2 = w1,2 =
= pv×ln 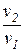 = pv×ln = pv×ln 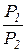 ,
t 1,2 = 1 ,
t 1,2 = 1
| q1,2 = Du1,2 + l1,2 = = Dh1,2 + w1,2 |
| Адиабатный δ q = 0, pvk = idem | n = k = ns =

| 
| l1,2 =  ,
w1,2 = k× ,
w1,2 = k×  ,
t 1,2 = ,
t 1,2 =  = =  =
= =
=  = = 
| q1,2 = 0 |
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1013; Нарушение авторских прав?; Мы поможем в написании вашей работы!