
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поляризация электродов
|
|
|
|
Электрохимические системы рассматриваются в равновесном и неравновесном состояниях. Основным условием перехода системы из равновесного состояния в неравновесное является протекание через нее электрического тока. Переход электрохимической системы при этом сопровождается изменением величины электродного потенциала. Разность между потенциалом (J) электрода под током и равновесным потенциалом (Jp) в том же электролите называется электродной поляризацией (η):
η = J − Jp (50)
Различают химическую поляризацию и концентрационную поляризацию.
Химическая поляризация возникает вследствие того, что выделение продуктов электролиза приводит к образованию гальванической цепи. Например, при электролизе водного раствора CuSO4 с платиновыми электродами происходит выделение меди на катоде и кислорода на аноде. Это приводит к тому, что первоначальная ванна превращается в гальваническую цепь Cu|CuSO4|(O2)Pt, э.д.с. которой противодействует электролизу и обусловливает поляризацию электродов. Подобным же образом при электролизе раствора H2SO4 выделяющиеся водород на катоде и кислород на аноде образуют цепь: Pt(H2)|H2SO4|(O2)Pt, возникновение которой вызывает поляризацию и противодействует электролизу.
Концентрационная поляризация возникает вследствие того, что по мере проведения электролиза концентрации электролита в анодном и катодном пространствах становятся различными. Например, при электролизе раствора AgNO3 с серебряными электродами возникает концентрационный элемент, э.д.с. которого направлена против наложенной разности потенциалов.
Поляризацию обоих видов можно уменьшить, осуществляя деполяризацию. Путем достаточно энергичного перемеивания в значительной степени можно уменьшить концентрационную поляризацию. Химическую поляризацию можно ослабить прибавлением специальных веществ. Так, для ослабления поляризации, обусловленной выделением на катоде водорода, деполяризаторами служат различные окислители, а для ослабления поляризации, создаваемой выделением на аноде кислорода, деполяризаторами могут быть соответствующие восстановители.
Электродная поляризация является функцией тока: чем выше плотность тока, тем больше значение поляризации. Экспериментальная формула Тафеля:
η = а + b lg i (51)
отображает также влияние материала электрода на перенапряжение, поскольку постоянные а и b неодинаковы для различных материалов.
Для Pt, Pd величина а, следовательно, и перенапряжение относительно невелики; в то же время можно выделить группу металлов с высокими значениями а и перенапряжения (Sn, Cd, Hg, Pb). Коэффициент b при переходе от одного металла к другому меняется мало и в среднем составляет 0,11-0,12.
Часто в электролите присутствуют несколько видов катионов и анионов. Например, в водных растворах солей кроме анионов и катионов соли всегда имеются ионы Н+ и ОН-.
Поэтому возможно протекание нескольких электродных реакций. Для катодного восстановления все окислители можно разделить на три группы:
а) ионы металлов, потенциал которых более отрицателен, чем потенциал водородного электрода. К ним относятся ионы щелочных и щелочно-земельных металлов.
В водных растворах разряд этих ионов практически не происходит, на катоде выделяется водород:
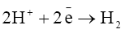
Активные металлы могут быть получены электролизом их расплавленных солей, в которых ионы Н+ отсутствуют;
б) окислители, потенциал которых более положителен, чем потенциал водородного электрода. К ним относятся ионы Cu2+, Ag+, Hg2+, Au3+, платиновых металлов, а также кислород, галогены, диоксид свинца, перманганат – ион и др. При наличии этих веществ в растворе они разряжаются в первую очередь и разряд ионов Н+ не происходит;
в) ионы, потенциал которых относительно мало отличается от потенциала
водородного электрода. К ним относятся ионы Sn2+, Pb2+, Ni2+, Co2+, Zn2+, Cd2+ и других металлов, находящихся между алюминием и водородом по величине стандартного электродного потенциала. Потенциалы металлов от рН не зависят. При некоторой плотности тока потенциал выделения водорода становится отрицательнее, чем потенциал выделения металла. Например, равновесный потенциал цинкового электрода отрицательнее потенциала водородного электрода, при малых плотностях тока на катоде выделяется лишь один водород.
При электролизе часть количества электричества расходуется на выделение водорода, часть – на выделение цинка. Доля общего количества электричества (в %), которая расходуется на выделение одного из веществ, называется выходом по току этого вещества:

где Bj - выход по току j-го вещества;
Qj – количество электричества, израсходованное на превращение j-го вещества;
Q – общее количество электричества, прошедшее через электрод.
Вследствие высокого водородного перенапряжения из водных растворов удается выделять на катоде Mn, Zn, Cr, Fe, Cd, Co, Ni и другие металлы.
На аноде должны реагировать наиболее сильные восстановители – вещества, имеющие наиболее отрицательный потенциал.
Если потенциал металлического анода имеет более отрицательное значение, чем потенциал ионов ОН-, то происходит растворение металла:
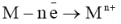
При этом протекает электролиз с растворимым анодом.
Если потенциал металлического анода близок к потенциалу других электродных процессов, то наряду с растворением металла на аноде протекают также другие процессы, например, разряд ионов ОН-:

В этом случае также говорят об электролизе с растворимым анодом, но учитывают и другие анодные процессы.
Если потенциал металла или другого проводника первого рода имеет более положительное значение, то протекает электролиз с нерастворимым анодом. В качестве нерастворимых анодов применяют золото и платиновые металлы, диоксид свинца и другие вещества, а также графит. Некоторые металлы практически не растворяются из-за высокой анодной поляризации, например никель и железо в щелочном растворе, свинец в H2SO4, титан, тантал, нержавеющая сталь.
При наличии в растворе ионов галогенов вследствие высокой поляризации реакции выделения кислорода в первую очередь на аноде выделяется йод, затем – бром. При наличии ионов Cl- в растворе при малых плотностях тока идет выделение кислорода, при высоких плотностях тока наряду с этой реакцией идет также окисление ионов Cl- и выделение Cl2. Фтор из за положительного значения потенциала не может быть выделен из водных растворов на аноде, его получают электролизом расплавленных фторидов. На
аноде не окисляются также ионы  -, поэтому в их присутствии в растворе на нерастворимом аноде протекает лишь реакция выделения кислорода:
-, поэтому в их присутствии в растворе на нерастворимом аноде протекает лишь реакция выделения кислорода:

Итак, последовательность электродных процессов определяется значениями потенциалов этих процессов и поляризации при их протекании.
Электролиз широко используется в различных областях промышленности.
|
|
|
|
|
Дата добавления: 2015-05-07; Просмотров: 1369; Нарушение авторских прав?; Мы поможем в написании вашей работы!