
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водород, вода. Пероксид водорода
|
|
|
|
Теоретические сведения
Водород. Относится к элементам – органогенам, входит в состав живых систем. В организме человека содержится 9,7 (масс.) % водорода. Содержится в земной коре (1 %), атмосфере. Электронная конфигурация: 1Н 1s1
В Периодической Системе Д.И.Менделеева водород располагается в первой (со щелочными металлами) и седьмой (с галогенами) группах, главных подгруппах, так как, имея один электрон, может и отдавать его, проявляя восстановительную способность (NH3, H2O), и принимать один электрон до устойчивой конфигурации 1s2 , проявляя свойства окислителя (NaH, CaH2 – гидриды). Электронное семейство: s- элемент. Характерные степени окисления +1, 0, -1.
Уникальность атома водорода заключается в том, что его единственный валентный электрон находится непосредственно в поле ядра атома и не экранируется другими электронами, что обеспечивает ему специфические свойства.
Получение водорода:
1. В лаборатории водород может быть получен взаимодействием активных металлов с водой или металлов, стоящих в ряду электрохимических потенциалов до водорода, с кислотами:
2Na(т.) + 2H2O(ж.) → 2NaOH(в.) + H2(г.)
Zn(т.) + 2HCl(в.) → ZnCl2(в.) + H2(г.)
2Al(т.) + 6H2O(ж.) + 6NaOH(в.) → 2Na3 [Al(OH)6] (в.) + H2(г.)
2. В промышленности водород получают
– из природного газа по реакции:
H2O(г.) + CH4(г.) ↔ CO(г.)+ 3H2(г.) (синтез – газ)
(с катализатором Ni и температурой 1200 К)
– электролизом воды: 2H2O(ж.) → 2H2(г.) + O2(г.)
– конверсионным методом: H2O(г.) + C(т.) ↔ CO(г.)+ H2(г.);
CO(г.)+ H2О(г.) ↔ CO2(г.)+ H2(г).; (700 К, катализатор – оксид железа)
– железопаровым методом: Fe(т.) + H2O(г.) → FeO(т.) + H2(г.)
Cвойства водорода. Молекула водорода двухатомна – Н2. Энергия связи (Ес в.) Н-Н составляет 436 кДж/моль), поэтому атомарный водород реакционноспособнее, чем молекулярный. Водород – газ без цвета, запаха и вкуса. Плотность – r273 К = 0,08988 г/дм3; Ткип. = -252,72 0С.
Вследствие неполярности молекулы и большой прочности при нормальных условиях молекулярный водород непосредственно активно взаимодействует только с фтором, а при действии света – с хлором и бромом. Большинство реакций с участием водорода протекает при высоких температурах, давлении и/или в присутствии катализатора.
В химических реакциях водород проявляет себя восстановителем, взаимодействуя с неметаллами и оксидами металлов и окислителем при взаимодействии с активными металлами.
Особо энергичным восстановителем является атомарный водород.
Характерный хлопок при внесении пробирки, заполненной водородом в пламя горелки – классическая качественная реакция на этот газ. При использовании больших объёмов водорода лёгкий хлопок превращается в мощный взрыв – реакция протекает по радикальному цепному механизму с разветвлением:
O2(г.)+ 2H2(г) →2H2O(г.)
При потере электрона образуется протон – Н+, существующий лишь в вакууме. В водных растворах образуется ион гидроксония Н+···Н2О или Н3О+ (более корректно – протон окружён четырьмя молекулами воды – Н9О4+).
Проявляя восстановительные свойства с активными металлами, водород образует гидриды: со щелочными металлами – солеобразные (LiH), с менее активными металлами – полимерные (AlH3) n, с d– и f –элементами металлоподобные гидриды – соединения нестехиометрического состава с металлическим типом связи.
Солеобразные (с преимущественно ионным типом связи) гидриды похожи на соединения металлов с галогенами. Это твёрдые кристаллические вещества с высокими температурами плавления, не проводящие электрический ток. Наличие гидрид – иона Н– подтверждается выделением водорода на аноде при электролизе расплавов гидридов. В водных растворах гидридов протекает полный гидролиз с выделением водорода (высокая восстановительная активность которого в момент выделения используется в металлургии для снятия окалины с листов проката):
LiH(т) + H2O(ж.) → LiOH(в) + H2(г).
Металлоподобные гидриды – твёрдые хрупкие вещества с металлическим блеском и значительной электрической проводимостью.
C неметаллами водород образует бинарные соединения ковалентного типа с разной степенью полярности связи. Многие из них газообразны. Бинарные соединения водорода с галогенами в водных растворах проявляют свойства сильных кислот – HCl, HBr, HI. Бинарные соединения с халькогенами в водных растворах проявляют свойства слабых кислот – H2S, H2Se, H2Te.
Известны комплексные гидриды: Li[BH4], Al[BH4]3.
Бинарным соединениям водорода с сильно электроотрицательными элементами присущ межмолекулярный тип взаимодействия – водородная связь, которая образуется между атомами водорода одной молекулы и электроотрицательными атомами другой и изменяет свойства и реакционную способность многих соединений. Так, фтороводород не проявляет в водных растворах свойств сильной кислоты, формируя равновесную систему:
HF + H2O ↔ H3O+ + F-, Ka = 7,2·10-4
F– + HF ↔ HF2-.
Фтористый водород и его водный раствор – плавиковая кислота разрушают кварц и стекло в результате образования газообразного фторида кремния SiF4:
4HF(г) + SiO2(т) → SiF4(г) + 2H2O;
6HF(ж) + SiO2(т) → H2[SiF6] (в) + 2H2O(ж).
Водород используется для промышленного синтеза аммиака, хлороводорода, спиртов, альдегидов, кетонов; для гидрогенизации твёрдого и жидкого топлива, жиров; для очистки продуктов переработки нефти; при сварке и резке металлов кислородно-водородным пламенем (≈2800 0С), при атомарно-водородной сварке (≈4000 0С); в металлургии для восстановления металлов; изотопы водорода – дейтерий и тритий – используются в атомной энергетике.
Вода. Одно из важнейших химических соединений Природы – Н2О. Она является главной составной частью живого организма и универсальной средой для протекания биохимических процессов. Вода, особенности которой определяются её составом и строением, является уникальным ионизирующим растворителем.
Молекула воды имеет тетраэдрическую структуру. Две вершины тетраэдра заняты атомами водорода, связанными с двумя неспаренными электронами атома кислорода ковалентными связями, две другие – вакантны и способны к донорно-акцепторному взаимодействию (рис.1).
 8О 1s2, 2s2,2p4 n=2 ¯ ¯ О
8О 1s2, 2s2,2p4 n=2 ¯ ¯ О
|
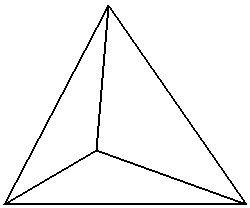
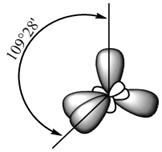
Рис.1. Строение молекул воды.
Молекула воды полярна, дипольный момент её равен 1,86 Д. Полярность молекул воды обеспечивает диссоциацию веществ с ионным и полярным ковалентным типом связи.
Другим важнейшим свойством молекул воды является их способность образовывать между собой водородные связи. Так, в структуре льда реализованы межмолекулярные водородные связи за счёт электростатического и донорно-акцепторного взаимодействия. Каждая молекула воды образует связи с четырьмя другими (координационное число молекулы воды в структуре льда равно четырём) (рис.2).


|




|


|
 Н О
Н О|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 3430; Нарушение авторских прав?; Мы поможем в написании вашей работы!