
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства соединений s-элементов. Бинарные соединения
|
|
|
|
1. Соединения с водородом – гидриды s-элементов являются сильнейшими восстановителями и подвергаются в водных растворах полному гидролизу:
NaН(т) + Н2О(ж) → NaОН(в) + Н2
CaН2(т) +2Н2О(ж) → Ca(ОН)2(в) + Н2
2. Соединения с кислородом – все s-элементы образуют соединения с кислородом. При горении в кислороде только Li образует оксид Li2О, натрий образует пероксид Na2О2, остальные s1 – элементы образуют надпероксиды – КО2, RbО2, CsО2.
Пероксид натрия в воде подвергается гидролизу с образованием щёлочи и Н2О2:
Na2О2(т) +2Н2О(ж) → 2NaОН(в) + Н2О2,
а также взаимодействует с углекислым газом с выделением кислорода:
2Na2О2(т) + 2CО2 → 2Na2СО3 + О2(г).
Пероксид натрия проявляет двойственные – и окислительные, и восстановительные свойства:
(окислитель)
 Na2О2(т) + 2KI(в) + Н2SО4(в) → Na2SО4(в) + K2SО4(в) + I2(т) + Н2О(ж)
Na2О2(т) + 2KI(в) + Н2SО4(в) → Na2SО4(в) + K2SО4(в) + I2(т) + Н2О(ж)
5Na2О2 + 2KMnO4 + 8Н2SО4 → MnSО4 + K2SО4 + 5Na2SО4 + 5О2 + 8Н2О
(восстановитель)
С водой надпероксиды взаимодействуют по схеме:
2МеО2(т) + 2Н2О(ж) → 2МеОН(в) + Н2О2(в) + О2(г).
Пероксиды и надпероксиды применяют для регенерации воздуха в закрытых помещениях и изолирующих противогазах:
4МеО2(т) + 2CО2(г) → 2Ме2СО3(т) + 3О2(г)
Нормальные оксиды щелочных металлов получают косвенным путём или при недостатке кислорода. Они бурно (кроме Li2О) реагируют с водой с образованием гидроксидов (щелочей) и выделением большого количества тепла.
Щелочноземельные металлы по отношению к кислороду ведут себя подобно щелочным металлам: образуют оксиды (CaО) и пероксиды (SrО2, BaО2), взаимодействующие с водой аналогично оксидам и пероксидам щелочных металлов.
3. Гидроксиды. Гидроксиды щелочных металлов представляют собой бесцветные, гигроскопичные вещества с преимущественно ионным типом связи. Они разъедают большинство соприкасающихся с ним материалов и в практике их называют «едкими щелочами».
Все они легкоплавки, термически устойчивы, при высоких температурах испаряются без разложения (отщепляет воду только LiОН).
В воде гидроксиды хорошо растворимы, полностью ионизированы – являются сильными основаниями. Растворимость и основные свойства усиливаются в ряду слева направо: LiОН, NaОН, КОН, RbОН, CsОН.
В твёрдом состоянии и в растворах гидроксиды щелочных металлов легко поглощают CО2 : NaОН(в) + CО2(г) → NaНСО3(в), а так жевыщелачивают SiО2 из состава стекла, поэтому их хранят в герметически закрытой полиэтиленовой таре.
Наибольшее применение из гидроксидов щелочных металлов имеют NaОН и КОН.
Их получают электролизом водных растворов хлоридов в промышленных электролизёрах с разделёнными анодным и катодным пространствами:
NaCl(в) → Na+(в)+ Cl-(в)
катод(-) анод(+)
2Н2О(ж) + 2е → Н2(г) + 2ОН-(в) 2Cl-(в) – 2е → Cl2(г)
Na+(в)
Гидроксид натрия накапливается в растворе в прикатодном пространстве.
Основные свойства и растворимость в воде гидроксидов щелочноземельных металлов возрастают в ряду Ca(ОН)2, Sr(ОН)2, Ba(ОН)2 слева направо.
Гидроксид бериллия нерастворим в воде и проявляет амфотерный характер:
Be(ОН)2(т) +2Н+(в) +2Н2О(ж) → [Be(Н2О)4]2+(в)
Be(ОН)2(т) +2ОН-(в) → [Be(ОН)4]2-(в)
Гидроксид магния плохо растворим в воде, и лишь при достаточно долгом кипячении водная фаза окрашивает фенолфталеин в малиновый цвет.
Как и все нерастворимые в воде основания, гидроксид магния получают косвенным путём – действием щёлочи на раствор соли:
MgSО4(в) + 2 NaОН(в) → Mg(ОН)2(т) + Na2SО4(в)
Mg2+(в) + 2ОН-(в) → Mg(ОН)2(т)
Гидроксид магния проявляет основной характер, но не относится к сильным основаниям. Его способность растворяться в растворах солей аммония используется в химическом анализе для предотвращения образования осадка:
Mg(ОН)2(т) + NН4Cl(в) → MgCl2(в) + 2NН3(г) + 2Н2О(ж).
4. Соли. Соли щелочных металлов имеют ионную структуру, термически устойчивы, в большинстве своём, хорошо растворимы в воде. Катионы их, приобретая устойчивую электронную конфигурацию инертных газов, бесцветны в твёрдом состоянии и в растворе. В водных растворах соли проявляют свойства сильных электролитов – полностью диссоциируют на ионы, образуя катионы с разной степенью гидратации и поляризующим действием. Наиболее сильным поляризующим действием обладает ион Li+ (имеющий малый радиус и, как следствие, большую плотность заряда), подвергающийся сильной гидратации. Ион лития, имеющий двухэлектронную оболочку гелия, образует комплексные соединения с координационным числом 4, например гидрат [Li (Н2О)4]+(в) и многочисленные двойные соли.
При возрастании радиусов катионов, имеющих восьмиэлектронную оболочку предыдущего инертного газа, поляризующее действие и, следовательно, гидратация уменьшаются. Эти большие ионы не склонны к образованию комплексных соединений, большинство их солей не образует кристаллогидратов (исключение составляют кристаллогидраты Na2SО4 · 10 Н2О, Na2СО3 · 10 Н2О), аквакомплексы их неустойчивы.
Малорастворимых солей щелочных элементов немного и образованы преимущественно крупными, легко поляризующимися ионами. К ним
относятся фторид, карбонат и фосфат лития, гексагидроксостибат натрия Na[Sb(OH)6], KClO4, уранилацетат цинка натрия гексагидрат NaZn[UO2(CH3COO)3]·6Н2О. Многие из них применяются в аналитической химиидля обнаружения или количественного определения соответствующих ионов.
Характерная собенность щелочных металлов – образование кислых солей. Склонность к их образованию возраствает в ряду Li → Cs.
Термическая устойчивость солей увеличивается с ростом атомной массы. Нитраты щелочных элементов – легкоплавкие соли, выше 500 оС они разлагаются с выделением кислорода:
NaNО3(т) 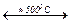 NaNО2(т)+ 1/2О2(г)
NaNО2(т)+ 1/2О2(г)
2NaNО3(т) 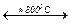 Na2О (т)+ N2 + 5/2О2(г)
Na2О (т)+ N2 + 5/2О2(г)
Соли щелочных металлов, образованные слабыми кислотами, гидролизуются по аниону и их растворы имеют сильно щелочную реакцию:
Na2CO3 + H2O = NaHCO3 + NaOH
CO32- + H2O = HCO3- + OH-
Водный раствор гидрокарбоната натрия (питьевая сода) вследмтвие гидролиза имеет слабощелочную реакцию среды. Это позволяет использовать прием его внутрь для нейтрализации повышенной кислотности желудочного сока и поддержания кислотно-основного равновесия в организме:
NaНCO3 + H2O = H2CO3 + NaOH
НCO3- + H2O = H2CO3 + OH-
Растворы сульфидов щелочных металлов применяют в аналитической химии для осаждения малорастворимых сульфидов других металлов.
Натрий, калий, магний и кальций являются биологически активными (биогенными) элементами и играют огромную биологическую роль в жизненных процессах. Ионы натрия (и лития) относятся к числу внеклеточных, а калия, (рубидия и цезия) – к числу внутриклеточных ионов. Они регулируют осмотическое давление крови, гидрофильно-липофильный баланс, участвуют в передаче нервных возбуждений, активизируют многие ферментативные процессы. Ион магния является комплексообразователем в хлорофилле, играющем важную роль в процессе фотосинтеза. Во внутриклеточной жидкости АТФ и АДФ присутствуют в основном в виде комплексов с магнием. В отличие от магния, ион кальция является внеклеточным ионом. Основная часть кальция содержится в костной ткани. Ионы лития (Li2CO3), выравнивая натрий – калиевый баланс, оказывают благоприятный эффект при лечении психических нарушений (маниакальной депрессии). Терапевтический эффект объясняется конкурирующим взамиодействием Li+ и Mg2+ с биологическими лигандами. Соединения s- элементов содержатся в пищевых продуктах и лекарственных препаратах.
Соли шелочных металлов находят широкое применение в фармации. Наиболее широко применяются соли натрия, соли калия используются меньше вследствие токсичности иона калия.
NaCl – хлорид натрия, поваренная соль. Используется в пищевой промышленности для консервирования продуктов питания, в химической промышленности для получения хлора, гидроксида натирия, соляной кислоты, металлического натрия. В медицине 0,9% раствор импользуется для компенсации кровопотерь (физиологический раствор, изотоничный плазме крови). Гипертоническуие астворы применяют наружно при воспалитеьных процессах.
NaBr и KBr используют как седативные (успокаивающие) средства. NaI и KI используют для приготовления растворов йода. В аналитической химии иодиды, сульфиды и сульфиты натрия и калия применяют в качестве восстановителей. Их восстановительные свойства обусловлены анионами – восстановителями. Ионы щелочных металлов практически лишены окислительных свойств.
Соли лития используют для устранения почечных камней, тка как ион лития дает легко растворимые соли с мочевой кислотой.
В солях щелочноземельных металлов возрастает доля ковалентной связи. Наиболее значительна она в галогенидах бериллия. Ион бериллия, имеющий малфй радиус и большое значение ионного потенциала, оказывает сильное поляризующее действие на анион. Поэтому для бериллия характерна склонность к комплексообразованию. Координационное число бериллия равно 4, с лигандом он образует четыре ковалентные связи, две из которых донорно-акцепторные, что отвечает sp3 – гибритизации атомных орбиталей атома бериллия и тетраэдрическому расположению связей.
Магний проявляет некоторое сходство с литием и цинком. Катионы лития и магния одинаково ведут себя во многих аналитических реакциях. В комплексных соединениях и кристаллогидратах координационное число иона магния равно 6: MgCl2·6H2O, KCl·MgCl2·6H2O .
Соли бериллия и магния и сильных кислот легко гидролизуются, их водные растворы имеют кислую реакцию среды:
[Mg(H2O)6]2+ + H2O = [MgOH(H2O)5]+ + H3O+
Mg2+ + H2O = MgOH+ + H+
MgCl2 + H2O = MgOHCl + HCl
Многие соли щелочноземельных металлов, например, карбонаты, сульфаты, фосфаты, фториды, оксалаты, в отличии от аналогичных солей щелочных металлов,трудно растворимы в воде. Растворимостьсолей и склонность к образованию кристаллогидратов снижается с ростом порядкового номера элемента.
В аналитической химии малая растворимость MgNH4PO4·6H2O, оксалатов кальция, стронция и бария, BaSO4, BaCrO4, CaF2 используют для обнаружения и количественного определения соответствующих ионов.
Из водных растворов ионы Be2+ и Mg2+ осаждаются в виде основных карбонатов переменного состава, а Са2+, Sr2+ и Ва2+ в виде средних карбонатов. При действии избытка СО2 на осадок карбоната кальция, он астворяется, образую гидрокарбонат:
СаСО3 + СО2 + Н2О = Са(НСО3)2
Малорастворимые в воде карбонаты щелочноземельных металлов растворяются в кислотах:
МеСО3 + 2Н+ = Ме2+ + Н2О + СО2
При нагревании карбонаты разлагаются:
МеСО3 = МеО + СО2
Термическая устойчивость карбонатов возрастает при переходе от ВеСО3 к ВаСО3, что согласуется со значениями ∆G термической диссоциации карбонатов. Реакция термического разложения карбонатов используется для получения оксидов кальция и магния.
Высокие отрицательные значения стандартных редокс-пар свидетельствуют об устойчивости катионов этих металлов к действию восстановителей.
Соединения бериллия ирастворимые соли бария токсичны.
Многие соединения магния и кальция используют как лекарственные препараты: MgSO4·7H2O – слабительное, успокаивающее, спазмолитическое средство; MgO, Mg(OH)2·3MgCO3·3H2O – для нейтрализации повышенной кислотности желудочного сока; аскорбинат магния (MgC6H8O6) – противогипертоническое средство; CaCl2·6H2O оказывает антиаллергическое и противовоспалительное действие, снимает спазмы сердечной мышцы, активизирует свертывание крови, регулирует обмен кальция; аналогично действие глюконата кальция (Са(С6Н11О7)2·Н2О) и лактата кальция(Са(С3Н5О3)·5Н2О); жженый гипс (CaSO4·1/2H2O) применяют в хирургической практике для наложения фиксирующих повязок при переломах конечностей и в стоматологии; BaSO4 используется как рентгеноконтрастное средство.
СВОЙСТВА ЭЛЕМЕНТОВ IВ ГРУППЫ: Cu, Ag, Au
Медь, серебро и золото являются d -элементами, простые вещества – металлы: конфигурация наружных электронных оболочек атомов …
(n-1)d10ns1:
29Cu[18Ar]3d104s1; 47Ag[34Xe] 4d105s1; 79Au[54Kr] 4f145d106s1
Завершение предвнешней оболочки происходит за счет перехода одного s -электрона наружного слоя на предвнешнюю d -орбиталь. Такая d -оболочка недостаточно стабильна: в образовании химических связей у элементов подгруппы меди могут принимать участие и d- электроны предвнешнего слоя; поэтому Cu, Ag и Au могут проявлять степени окисления +1, +2, +3. На внешней электронной оболочке атомы меди, серебра и золота содержат по 1 электрону, как у атомов щелочных металлов, но на предвнешней – 18 – электронные оболочки (у атомов щелочных металлов – 8ē). Наличие 18 ē в предвнешней оболочке и более высокий заряд ядра у элементов подгруппы меди приводит к эффекту её сжатия. Вследствие этого радиусы атомов Cu, Ag и Au меньше радиусов атомов щелочных металлов тех же периодов, а энергия ионизации больше. Поэтому медь, серебро и золото резко отличаются от щелочных металлов более высокими значениями плотностей, температур плавления и кипения, положительными значениями электродных потенциалов, малой химической активностью (табл. 3, 4). Химическая активность убывает от меди к золоту: серебро и золото – благородные металлы, трудно поддающиеся окислению. Благодаря стойкости по отношению к химическим воздействиям, Cu, Ag и Au с древнейших времен находят широкое практическое применение.
Таблица 3
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1722; Нарушение авторских прав?; Мы поможем в написании вашей работы!