
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие энтропии
|
|
|
|
Для идеальной машины Карно справедливо, что
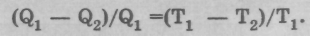
Отсюда получается равенство
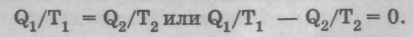
Так как количество теплоты Q2 отдается холодильнику, его надо взять со знаком «минус». Следовательно, получаем выражение
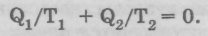
Будем писать  вместо Q, подчеркивая, что речь идет о порции
вместо Q, подчеркивая, что речь идет о порции 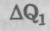 , полученной рабочим телом от нагревателя, и порции
, полученной рабочим телом от нагревателя, и порции 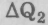 , потерянной им в холодильнике.
, потерянной им в холодильнике.

Полученное выражение напоминает закон сохранения, а это, в свою очередь, не может не привлечь внимания к величине 
В 1865 году Клаузиус ввел новое понятие «энтропия» (entropia — от греч. «поворот», «превращение»). Клаузис посчитал, что существует некоторая величина S, которая, подобно энергии, давлению, температуре, характеризует состояние газа. Когда к газу подводится некоторое количество теплоты  , то энтропия S возрастает на величину, равную
, то энтропия S возрастает на величину, равную 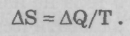
В предыдущей главе говорилось о том, что в течение длительного времени ученые не делали различий между такими понятиями, как температура и теплота. Однако ряд явлений указывал на то, что эти понятия следует различать. Так, при таянии льда теплота расходуется, а температура льда не изменяется в процессе плавления. После введения Клаузиусом понятия энтропии стало понятно, где пролегает граница четкого различения таких понятий, как теплота и температура. Дело в том, что нельзя говорить о каком-то количестве теплоты, заключенном в теле. Это понятие не имеет смысла. Теплота может передаваться от тела к телу, переходить в работу, возникать при трении, но при этом она не является сохраняющейся величиной. Поэтому теплота определяется в физике не как вид энергии, а как мера изменения энергии. В то же время введенная Клаузиусом энтропия оказалась величиной, сохраняющейся в обратимых процессах. Это означает, что энтропия системы может рассматриваться как функция состояния системы, ибо изменение ее не зависит от вида процесса, а определяется только начальным и конечным состояния-
ми системы. Покажем, что в идеальном цикле Карно энтропия сохраняется.
Рассмотрим величину  , которая означает бесконечно малое приращение теплоты, настолько малое, что состояние системы характеризуется одним и тем же значением температуры, неизменным по всему объему рассматриваемой системы. То есть предполагается, что система во все моменты времени находится в тепловом и механическом равновесии, и любое изменение ее состояния слагается из последовательности равновесных состояний, каждое из которых лишь бесконечно мало отличается от предшествующего. Именно такой характер поведения системы реализуется в обратимых процессах.
, которая означает бесконечно малое приращение теплоты, настолько малое, что состояние системы характеризуется одним и тем же значением температуры, неизменным по всему объему рассматриваемой системы. То есть предполагается, что система во все моменты времени находится в тепловом и механическом равновесии, и любое изменение ее состояния слагается из последовательности равновесных состояний, каждое из которых лишь бесконечно мало отличается от предшествующего. Именно такой характер поведения системы реализуется в обратимых процессах.
Если процесс обратимый, как в круговом цикле Карно, то

Из этого соотношения следует, что энтропия рабочего тела на 1-й стадии возрастает ровно настолько, насколько она уменьшается на 3-й стадии. На 2-й и на 4-й стадиях энтропия рабочего тела не изменяется, так как процессы здесь протекают адиабатически, без теплообмена.
Иными словами, в случае обратимых процессов,
то есть 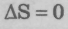
S = const — энтропия изолированной системы в случае обратимых процессов постоянна.
При необратимых процессах получаем закон возрастания энтропии: 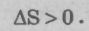
Для того чтобы осуществить обратимый процесс, необходимо, как это уже упоминалось, добиться очень медленного расширения или сжатия рабочего тела, чтобы изменения системы представляли собой последовательность равновесных состояний. В таком цикле совершение какой-либо полезной работы потребует бесконечно большого времени. Чтобы получить работу в короткие промежутки времени, то есть хорошую мощность, приходится нарушать условия идеального цикла. А это сразу приведет к неодинаковости температуры на разных участках системы, к потокам тепла от более горячих участков к менее горячим, то есть к возрастанию энтропии системы.
Для описания термодинамических процессов I начала термодинамики оказывается недостаточно, ибо I начало
термодинамики не позволяет определить направление протекания процессов в природе. Тот факт, что энтропия изо лированной системы не может убывать, а только возрастает и достигает максимального значения в равновесном состоянии, является отражением того, что в природе возможны процессы, протекающие только в одном направлении — в направлении передачи тепла только от более горячих тел менее горячим.
Существуют различные формулировки II начала термодинамики. Все они являются эквивалентными. Приведем некоторые из них:
1. Невозможны такие процессы, единственным конеч
ным результатом которых был бы переход тепла от
тела, менее нагретого, к телу, более нагретому.
В природе возможны процессы, протекающие только в одном направлении — в направлении передачи тепла только от более горячих тел менее горячим.
2. КПД любой тепловой машины всегда меньше 100
%, то есть невозможен вечный двигатель (перпетуум-мо
биле) II рода (так как невозможно построить тепловую
машину, работающую не за счет перепада теплоты, а за
счет теплоты одного нагревателя).
КПД любой реальной тепловой машины всегда меньше КПД идеальной тепловой машины.
3. Энтропия изолированной системы при протекании
необратимых процессов возрастает, ибо система, предо
ставленная самой себе, переходит из менее вероятного со
стояния в более вероятное. Энтропия системы, находя
щейся в равновесном состоянии, максимальна и постоян
на 
Эту последнюю формулировку требуется обсудить более подробно.
|
|
|
|
|
Дата добавления: 2015-05-07; Просмотров: 518; Нарушение авторских прав?; Мы поможем в написании вашей работы!