
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтальпия образования соединений
|
|
|
|
Термохимия. Закон Гесса
Тепловые эффекты реакций можно определить экспериментально и с помощью термохимических расчётов. При расчётах используют термохимические уравнения. Это уравнения химических реакций, в правой части которых указан тепловой эффект.
Термохимические расчёты проводят на основе закона Гесса: тепловой эффект реакции (при Р –, V – const или Т –, Р – const) не зависит от пути, по которому проходит процесс, а определяется только природой исходных веществ и продуктов реакции и их состоянием.
Согласно закону Гесса при расчётах с термохимическими уравнениями можно производить те же действия, что и с алгебраическими, т.е. переносить члены уравнения из одной части в другую, складывать, вычитать и т.д.
Закон Гесса позволяет вычислить тепловые эффекты химических реакций, процессов растворения и фазовых превращений.
К фазовым превращениям относятся процессы, связанные с переходом из одного агрегатного состояния в другое (сублимация, испарение, плавление и др.), а также переход из аморфного состояния в кристаллическое, превращение одной модификации в другую и т.д. Фазовые превращения записываются в виде уравнений, подобных термохимическим:
| 1) испарение: Hg(ж) ® Hg(г), | DН = +60,8 кДж; |
| 2) переход из аморфного состояния в кристаллическое: | |
| В2О3(аморф) ® В2О3(кр), | DН = –18,4 кДж. |
При фазовых превращениях «твёрдое вещество» ® «жидкость» ® «газ» теплота поглощается, т.е. это процессы эндотермические Q < 0, DH > 0 потому, что каждое последующее состояние по сравнению с предыдущим характеризуется увеличением подвижности частиц, образующих вещество. Такая возрастающая подвижность частиц связана с частичным разрывом связей в структуре вещества, что требует затраты энергии. Обратный переход сопровождается выделением теплоты – процессы экзотермические Q > 0, DH < 0.
Переход вещества из аморфного состояния в кристаллическое сопровождается выделением тепла (Q > 0, DH < 0), что связано с упрочнением связи. Если кристаллическое вещество превращается в аморфное, то теплота поглощается
(Q < 0, DH > 0), эта теплота идёт на разрушение кристаллической решётки.
Под энтальпией образования соединения (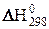 обр) понимают изменение энтальпии для реакции образования одного моля данного химического соединения из простых веществ. При этом энтальпия образования простых веществ (N2, О2, Н2, Сграфит и др.) принимается равной нулю. Стандартная энтальпия образования вычисляется при стандартных условиях: 25 °С (298 К) и Р = 1 атм, обозначается
обр) понимают изменение энтальпии для реакции образования одного моля данного химического соединения из простых веществ. При этом энтальпия образования простых веществ (N2, О2, Н2, Сграфит и др.) принимается равной нулю. Стандартная энтальпия образования вычисляется при стандартных условиях: 25 °С (298 К) и Р = 1 атм, обозначается 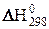 и измеряется в кДж/моль.
и измеряется в кДж/моль.
Энтальпия образования химического соединения равна по абсолютной величине и противоположна по знаку энтальпии разложения этого соединения на простые вещества при стандартных условиях, т.е. 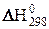 обр = –
обр = – 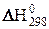 разл (закон Лавуазье-Лапласа).
разл (закон Лавуазье-Лапласа).
Чем больше отличаются между собой элементы, входящие в состав соединения по значению относительной электроотрицательности (ОЭО), тем меньше величина энтальпии образования. В то же время разность значений относительных электроотрицательностей (D ОЭО) элементов качественно определяет вид химической связи между ними. А именно, соединения с ионной связью образованы элементами, у которых эта разность наибольшая (D ОЭО > 2). Ковалентные соединения с полярной связью образуются между элементами, имеющими D ОЭО £ 2, а с неполярной связью – при D ОЭО = 0. Отсюда следует, что при переходе от молекул с ковалентной неполярной связью к молекулам с ковалентной полярной связью, а затем с ионной, величина энтальпии образования должна уменьшаться. Так, например, согласно данным таблицы, наблюдаем, что от LiCl к CCl4 D ОЭО уменьшается. Следовательно, уменьшается полярность связи и в той же последовательности возрастает величина энтальпии образования.
| Вещество | LiCl | ВеCl2 | ВCl3 | CCl4 |
| D ОЭО | 2,0 | 1,5 | 1,0 | 0,5 |
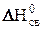 , рассчитанная на одну связь Э–Cl, кДж , рассчитанная на одну связь Э–Cl, кДж
| –408,3 | –233,8 | –134,3 | –33,2 |
1.4. следствие из закона Гесса. Термохимические расчёты
Зная стандартные энтальпии образования химических соединений, тепловой эффект реакции можно рассчитать, пользуясь следствием из закона Гесса.
Согласно следствию из закона Гесса для процессов, которые протекают при
Р = const, тепловой эффект (изменение энтальпии) реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с соответствующими стехиометрическими коэффициентами.
Для реакции, представленной в общем виде
а А + b B = c C + d D (8)
тепловой эффект в математической форме записывается следующим образом:
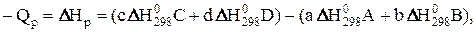 (9)
(9)
| где Qр и DНр | – соответственно тепловой эффект и изменение энтальпии реакции; |
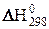
| – стандартные энтальпии образования исходных веществ А и В и продуктов реакции C и D; |
| a, b, c, d | – стехиометрические коэффициенты, соответствующие исходным веществам и продуктам реакции. |
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 1349; Нарушение авторских прав?; Мы поможем в написании вашей работы!