
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окисление оксида азота (II) и димеризация оксида азота (IV)
|
|
|
|
Нитрозные газы, полученные при окислении аммиака, содержат NO и другие оксиды азота, кислород, азот и пары воды. Для получения азотной кислоты оксид азота (II) необходимо окислить до диоксида.
При окислении оксида азота (II) в оксид азота (IV) протекают три параллельных реакции:
2NO+O2 ⇄ 2NO2-∆H, где: ∆H= 112,3 кДж (7.5)
2NO2 ⇄ N2O4 -∆H, где: ∆H=57,0 кДж (7.6)
NO2+NO ⇄ N2O3-∆H, где: ∆H=40,0 кДж (7.7)
Все эти реакции обратимы, протекают в гомогенной системе с выделением тепла и уменьшением объема. Вследствие этого понижение температуры и повышение давления сдвигает равновесие их вправо.
Константа равновесия реакции (7.5) окисления оксида азота (II) выражается уравнением:
|
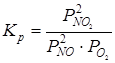 |
и сильно зависит от температуры (табл.7.1).
Таблица 7.1
Значение Кр реакции окисления оксида азота (II) для различных температур
| t0C | ||||||
| Kp | 1,24∙1014 | 1,82∙108 | 8,5∙104 | 2,1∙10-3 | 5,6∙10-3 | 1,5∙10-3 |
Из табл. 7.1. следует, что при температурах ниже 1000С равновесие реакции (7.5) почти полностью сдвинуто в сторону образования оксида азота (IV). При повышении температуры оно сдвигается влево и выше 7000С образования оксида азота (IV) практически не происходит. Так как нитрозные газы выходят из реактора при температуре около 8000С, в них оксид азота (IV) практически отсутствует. Для превращения оксида азота (II) в оксид азота (IV) газы необходимо охладить ниже 1000С.
Обычно переработку нитрозных газов ведут при 10-500С. В этих условиях часть оксида азота (IV) димеризуется в тетроксид N2O4. Степень димеризации его существенно зависит от температуры. При температуре выше 1500С равновесие реакции (7.6) почти полностью сдвинуто влево и тетроксид азота в газе практически отсутствует. Даже при –200С степень димеризации оксида азота (IV) не превышает 92%.
Скорости реакции (7.5) и (7.6) различны, поэтому соответствующие равновесия устанавливаются не одновременно. Реакция окисления (7.5) протекает с меньшей скоростью, поэтому скорость всего процесса на этой стадии производства определяется именно скоростью окисления оксида азота (II). Окисление оксида азота (II) – самая медленная стадия производства азотной кислоты. Её скорость выражается уравнением:
 |
Скорость реакции сильно зависит от концентрации реагентов давления и температуры. Для этой реакции характерна аномальная зависимость ее скорости от температуры. Она ускоряется при понижении температуры и почти полностью прекращается с повышением температуры до определенного предела. Это объясняется особым механизмом окисления оксида азота (II)в оксид азота (IV), которое протекает в две стадии через образование промежуточного продукта – димера оксида азота (II) (консекутивная реакция):
2NO ⇄ N2O2-∆H, (7.9)
N2O2+O2 ⇄ 2NO2-∆H. (7.10)
Реакция образования димера обратима, протекает с выделением тепла и значительно быстрее, чем реакция его последующего окисления. Поэтому при повышении температуры равновесие реакции образования димера сдвигается влево и равновесная концентрация димера в газе понижается. Так как скорость реакции окисления димера:
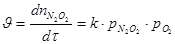 |
зависит от его концентрации, то уменьшение скорости при повышение температуры вызывает снижение скорости окисления димера и, следовательно, оксида азота (II) до оксида азота (IV).
Таким образом, уменьшение скорости окисления NO в NO2 с повышением температуры можно объяснить сильным снижением концентрации димера.
Повышение давления способствует сдвигу равновесия реакции (7.9) в сторону димера и увеличению скорости реакции (7.10). Повышается и степень абсорбции диоксида азота. Поэтому в настоящее время в производстве азотной кислоты перешли к установкам, работающим под давлением до 1 МПа.
Нитрозные газы, поступающие на абсорбцию, содержат NO2, N2O4, NO, N2O, N2O3, N2 и пары воды.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 8448; Нарушение авторских прав?; Мы поможем в написании вашей работы!