
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Абсорбция диоксида азота
|
|
|
|
Все оксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но, за исключением оксида азота (II), взаимодействуют с ней. Поглощение их водой сопровождается химической реакцией хемосорбции, протекающей в системе «газ-жидкость», описываемой уравнениями:
2NO2+H2O ⇄ HNO3+HNO2-∆H, где: ∆H = 116 кДж (7.11)
N2O4+H2O ⇄ HNO3+HNO2-∆H, где: ∆H = 59 кДж (7.12)
и распада нестойкой азотистой кислоты по уравнению:
3HNO2 ⇄ HNO3+2NO+H2O+∆H, где: ∆H = 76 кДж (7.13)
Суммируя уравнение (7.11) и (7.13), (7.12) и (7.13), получаем итоговые уравнения поглощения оксидов азота водой:
3NO2г+H2Oж ⇄ 2HNO3ж +NОг-∆H, где: ∆H=136 кДж, (7.14)
3N2O4г+2H2Oж⇄4HNO3ж + 2NОг-∆H, где: ∆H=101 кДж (7.15)
Из этих уравнений следует, что при абсорбции из трех моль оксида азота (IV) образуется два моля азотной кислоты и один моль оксида азота (II), который возвращается в цикл и снова окисляется до оксида азота (IV).
Механизм образования азотной кислоты при абсорбции оксида азота (IV) водой, а затем образующейся водной азотной кислотой, заключается в том, что оксид азота (IV) диффундирует через пограничный слой газа к поверхности жидкости и абсорбируется ею. При этом оксид азота (IV) реагирует с водой согласно реакции (7.11) со скоростью, прквышает скорость диффузии и скорость реакции разложения азотистой кислоты (реакция 7.13).
Далее в жидкой фазе происходит сравнительно медленное разложение азотистой кислоты по реакции (7.13). Образующейся NO частично окисляется в растворе кислородом, но его большая часть взаимодействует с кислородом уже в газовой фазе по реакции (7.5).
Одновременно с абсорбцией и протеканием химических реакций в растворе в газовой фазе частично происходят те же реакции, приводящие к образованию азотной кислоты. Медленным процессом, определяющим скорость поглощения оксидов азота, является диффузия их в жидкую фазу. При взаимодействии паров воды и диоксида азота в газовой фазе происходит образование кислотного тумана, вследствие этого создается дополнительное сопротивление при поглощение оксидов азота.
 |
Скорость процесса абсорбции диоксида азота водой описывается уравнением для гетерогенных процессов:
где ∆р-движущая сила абсорбции,
рNO2 - парциальное давление NO2 в газовой фазе,
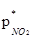 - равновесное давление NO2 у поверхности водного раствора азотной кислоты.
- равновесное давление NO2 у поверхности водного раствора азотной кислоты.
С повышением концентрации кислоты в процессе абсорбции возрастает равновесное давление оксида азота (IV) и снижается движущая сила процесса. Вследствие этого процесс абсорбции замедляется.
Состояние системы «NO2-HNO3-H2O», следовательно, концентрация получаемой азотной кислоты зависит от температуры, давления, парциального давления оксида азота (IV) в поглощаемой газовой смеси и концентрации образовавшейся кислоты. При понижении температуры и концентрации кислоты и повышения давления степень абсорбции оксида азота (IV) водной азотной кислотой возрастает, при том тем интенсивнее, чем выше концентрация его в нитрозных газах. При атмосферном давлении и температуре 250С абсорбция оксида азота практически прекращается, когда концентрация кислоты достигнет 0,65 мас. долей. При концентрации азотной кислоты выше 65% поглощение почти прекращается.
Таким образом, возможность получения азотной кислоты концентрацией более 0,65 мас. долей объективно ограничена температурой и давлением процесса абсорбции и содержанием оксида азота (IV) в нитрозных газах. В реальных условиях производства при температуре 400С, давлении 0,1 МПа и понижении содержания оксида азота вследствие его поглощения из газа концентрация получаемой кислоты не превышает 0,5 мас.дол.
Следует отметить, что степень окисления NO в NO2 зависит от свободного объема, а количество поглощаемых оксидов азота – от поверхности соприкосновения газа с жидкостью. Поэтому одно из основных требований, предъявляемое к абсорбционной аппаратуре, - создание максимального свободного объема при одновременно сильно развитой поверхности поглощения.
В промышленности используют различные типы абсорбционных колонн с колпачковыми тарелками, с ситчатыми тарелками, переливными стаканами и др.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 3236; Нарушение авторских прав?; Мы поможем в написании вашей работы!