
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Виконання реакції. У пробірку вміщують 2 краплини розчину солі Fe2+, 2 краплини (0,2 мл) сульфатної кислоти і додають 2 краплини (0,2 мл) 0,1н розчину калій перманганату
|
|
|
|
Виконання реакції
Виконання реакції
У пробірку вміщують 2 краплини розчину солі Fe2+, 2 краплини (0,2 мл) сульфатної кислоти і додають 2 краплини (0,2 мл) 0,1н розчину калій перманганату. Розчин КMnO4 знебарвлюється.
5.1.5. Характерні реакції на катіони Fe3+
Із загальноаналітичних реакцій характерними є реакції комплексоутворення та специфічні реакц відновлення ферум(ІІІ)-катіона до ферум(ІІ)-катіона.
5.1.5.1. Гексаціаноферрит калію К4[Fe(CN)6 ] утворює з іонами Fе3+ темно- синій осад ”берлінської лазурі”:
Fe3+ + К+ + [Fe(CN)6 ]4- → КFe[Fe(CN)6 ]2
Реакцію проводять в середовищі розбавленої НСl. Осад нерозчинний у кислотах, але розкладається лугами.
На скляну пластинку помістити 1 краплину розчину солі Fе3+ і додати 3-4 краплини розчину К4[Fe(CN)6]. Утворюється темно–синій осад. Виявленню Fе3+ заважають окисники.
5.1.5.2. Роданід амонію NH4SCN утворює з іонами Fе3+ розчинну суміш комплексних сполук складу [Fe(NCS) n ]3– n (n = 1–6), яка має насичене червоне забарвлення:
Fe3+ + nSCN- → [Fe(NCS) n ]3– n
Реакцію проводять у кислому середовищі.
До 1-2 крапель розчину, що містить іони Fе3+, додати 2-3 краплини розчину NН4SCN. Розчин забарвлюється в насичено-червоний колір.
За наявності іонів Cu2+, Hg22+, Hg2+, Bi3+ та деяких інших необхідно додавати великий надлишок NН4SCN. Червоне забарвлення комплексу не з'являється за наявності фториду натрію NаF, який зв'язує іони Fе3+ у більш стійкий, але безбарвний комплекс:
Fe(NO3)3 + 6NaF = Na3[FeF6] + 3NaNO3
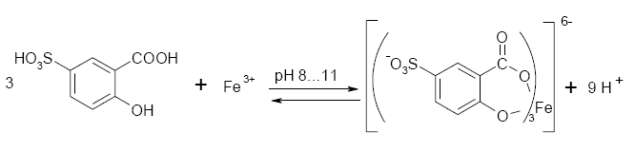
5.1.5.3. Реакція з сульфосаліціловою кислотою. Сульфосаліцилова кислота (2-оксі-5-сульфобензойна кислота) утворює з іонами Fe3+ ряд комплексів різного забарвлення, будова яких залежить від концентрації йонів гідрогену: в слабокислому середовищі при рН ≈ 2 – малиново-фіолетового кольору, в нейтральному середовищі при рН = 6-7 – бурого кольору, а в лужному середовищі при рН ≥ 8 – жовтого кольору.
При рН 8–11 утворюється забарвлена комплексна сполука ферум (ІІІ) трисульфосаліцилат жовтого кольору:
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 430; Нарушение авторских прав?; Мы поможем в написании вашей работы!