
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей есть тоже величина постоянная и называется константой равновесия
|
|
|
|
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей есть тоже величина постоянная и называется константой равновесия К данной системы:
Vпр =k1[CO][H2O]; Vобр = k2 [CO2][H2];
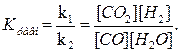
В условии задачи даны исходные концентрации, тогда как в выражение Кравн входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [CO2] = x моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ будут:
| Вещества | СО | Н2О | СО2 | Н2 |
| Сисход, моль/л | - | - | ||
| Прореагировало и образовалось | х | х | х | х |
| Сравн, моль/л | (3-х) | (2-х) | х | х |
Зная константу равновесия, находим значение х, а затем и равновесные концентрации всех веществ:
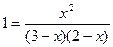 ;
;
х2 = 6 – 2х – 3х + х2; 5х = 6; х = 1,2 моль/л.
Таким образом, искомые равновесные концентрации:
[CO2] = 1,2 моль/л;
[H2] = 1,2 моль/л;
[CO] = 3 – 1,2 = 1,8 моль/л;
[H2О] = 2 – 1,2 = 0,8моль/л.
Пример 4. При некоторой высокой температуре константа равновесия Кс газовой реакции равна 4. Н2(г) + I2(г) ↔ 2HI(г).
Определить выход НI, если для реакции взято 4 моль/л водорода и 3 моль/л йода.
Решение.
Искомый выход, т.е. равновесную концентрацию HI, обозначим через х. Дальнейший ход решения тот же, что и в предыдущей задаче.
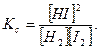
| Вещества | Н2 | I2 | HI |
| Сисход, моль/л | |||
| Прореагировало и получилось | 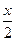
| 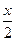
| x |
| Сравн, моль/л | 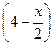
| 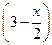
| x |
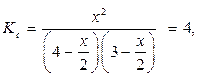 отсюда х=3,5 моль/л.
отсюда х=3,5 моль/л.
Пример 5. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
 РСl5(г) → РСl3(г) + Сl2(г); ΔН = + 92,59 кДж.
РСl5(г) → РСl3(г) + Сl2(г); ΔН = + 92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрации, чтобы сместить равновесие в сторону прямой реакции - разложения РСl5?
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 427; Нарушение авторских прав?; Мы поможем в написании вашей работы!