
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексные соединения
|
|
|
|
Комплексные соединения - это вещества, содержащие «центральный атом» – комплексообразователь, с которым в неионогенной связи находится определенное количество атомов, ионов или молекул, составляющих внутреннюю сферу.
При написании формул таких соединений комплексные ион или молекулы заключают в квадратные скобки, а справа вверху (для ионов) указывают их заряд (например, [Ag(NH3)2]+). Часть комплексного соединения, заключенная в квадратные скобки, называется внутренней сферой. Ионы, находящиеся снаружи, образуют его внешнюю сферу.
Центральный ион внутренней сферы, удерживающий около себя определенное число других ионов или молекул, называется комплексообразователем. С комплексообразователем связаны (координированы) полярные молекулы или ионы, которые называются лигандами (или аддендами).
Способность к образованию комплексных соединений связана с электронным строением атомов. Особенно легко образуют комплексные ионы элементы d-семейства, например: Ag+, Au3+, Cu2+, Hg2+, Zn2+, Fe2+, Cd2+ и др. Однако роль комплексообразователей могут играть и некоторые неметаллы, например кремний в комплексной соли K2[SiF6].
В качестве лигандов (аддендов) выступает целый ряд отрицательно заряженных ионов, например F-, OH-, NO 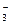 , CO
, CO 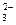 и др. Лигандами могут служить и электронейтральные полярные молекулы, такие как NH3, Н2О, РН3, СО и т. п.
и др. Лигандами могут служить и электронейтральные полярные молекулы, такие как NH3, Н2О, РН3, СО и т. п.
Количество химических связей между комплексообразователем и лигандами определяет координационное число комплексообразователя. Координационное число зависит в основном от природы комплексообразователя и лигандов, а также от условий образования комплексного соединения.
При составлении названия комплексного соединения используются следующие правила:
1) если соединение состоит из комплексного иона и ионов внешней сферы, т. е. является комплексной солью, то первым называется анион в именительном падеже, а затем катион в родительном падеже;
2) при названии комплексного иона сначала указываются лиганды, затем комплексообразователь;
3) молекулярные лиганды соответствуют названиям молекул (кроме воды и аммиака), для их обозначения применяются термины «аква» и «аммин».
К анионным лигандам добавляют окончание "о", например:
F- – фторо. O 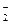 – оксо, CNS- – родано, Cl- – хлоро, NO
– оксо, CNS- – родано, Cl- – хлоро, NO 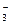 – нитрато, ОН- – гидроксо, Вг- – бромо, CN- – циано, SO
– нитрато, ОН- – гидроксо, Вг- – бромо, CN- – циано, SO 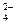 – сульфато, S2O
– сульфато, S2O 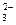 – тиосульфато, CO
– тиосульфато, CO 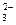 – карбонато, PO
– карбонато, PO 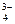 – фосфато, NO
– фосфато, NO 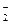 – нитро.
– нитро.
Для обозначения количества лигандов используются греческие числительные: 2 – ди-, 3 – три-, 4 – тетра-, 5 – пента-, 6- гекса-.
4) если комплексный ион – катион, то для названия комплексообразователя используют русское наименование элемента, если анион, то латинское. После названия комплексообразователя римской цифрой в круглых скобках указывают его степень окисления. У нейтральных комплексов название центрального атома дается в именительном падеже, а его степень окисления не указывается.
Например:
[Ag(NH3)2]Cl – хлорид диамминсеребра;
K2[PtCl6] – гексахлороплатинат (IV) калия;
[Ni(NH3)6][Co(NO2)6] – гексанитрокобальтат (III) гексаамминникеля (III).
Необходимо обратить внимание, что формула комплексного соединения читается в обратной последовательности ее записи.
В водном растворе комплексные соединения диссоциируют по типу диссоциации сильного электролита – на комплексный ион и ионы, составляющие внешнюю сферу, например:
Na3[Co(NO2)6] 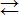 3Na++[Co(NO2)6]3–.
3Na++[Co(NO2)6]3–.
Внутренняя сфера типичных комплексных соединений в растворах может диссоциировать на ионы или на ионы и молекулы (по типу диссоциации слабого электролита). Например, ион
[Co(NO2)6]3- 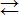 Co3+ + 6NO
Co3+ + 6NO 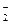 .
.
Электролитическая диссоциация комплексных ионов подчиняется закону действующих масс и количественно характеризуется константой диссоциации, которая носит название константы нестойкости Кн:
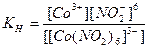 .
.
У типичных комплексных ионов Кн очень мала и является мерой его устойчивости.
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: а) К4[Fe(CN)6]; б) Nа[Ag(NO2)2]; в) К2[МoF8];
г) [Cr(H2O)2(NH3)3Cl]Cl2.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 699; Нарушение авторских прав?; Мы поможем в написании вашей работы!