
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Эквивалентный объем кислорода (н.у.)
|
|
|
|
Эквивалентный объем кислорода (н.у.) 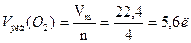 . Согласно закону Фарадея:
. Согласно закону Фарадея: 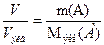 , отсюда находим массу гидроксида калия, образовавшегося у катода:
, отсюда находим массу гидроксида калия, образовавшегося у катода:
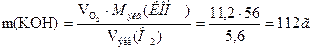
Контрольные задания
421. Электролиз раствора К2SO4 проводили при силе тока 5А в течение 3ч. Составьте электронные уравнения процессов, происходивших на электродах, вычислите объемы выделившихся на электродах веществ. Ответ: 5,03г; 6,266дм3; 3,133дм3.
422. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов AlCl3, NiSO4. В обоих случаях анод угольный.
423. При электролизе раствора CuSO4 на аноде выделилось 168 см3 кислорода, измеренного при н.у. Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде. Ответ: 0,953 г.
424. При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите молярную массу эквивалента металла. Ответ: 17,37 г/моль.
425. Электролиз раствора Nа2SО4 проводили в течение 5ч при силе токе 7А, составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде?
Ответ: 11,75 г; 14,62 дм3; 7,31 дм3.
426. Электролиз раствора нитрата серебра проводили при силе тока 2А в течение 4ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса серебра выделилась на катоде, и каков объем газа (н.у.), выделившегося на аноде?
Ответ:32,20 г; 1,67 дм3.
427. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите молярную массу эквивалента металла. Ответ: 32,7 г/моль.
428. Насколько уменьшится масса серебряного анода, если электролиз раствора АgNО3 проводить при силе тока 2А в течение 38 мин 20 с? Составьте электронные уравнения процессов, происходящих на графитовых электродах. Ответ: 4,47 г.
429. Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 дм3 кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока.
Ответ: 5,74 А.
430. Электролиз раствора СuSО4 проводили с медным анодом в течение 4ч при силе тока 50 А, при этом выделилось 224 г меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода. Ответ: 94,48%.
431. Электролиз раствора NаI проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вычислите массу веществ, выделившихся на катоде и аноде? Ответ: 0,56 г; 71,0 г.
432. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора АgNО3. Если электролиз проводить с серебряным анодом, то его масса уменьшается на 5,4 г. Определите расход электричества при этом.
Ответ: 4830 Кл.
433. Электролиз раствора СuSО4 проводили в течение 15мин при силе тока 2,5 А, выделилось 0,72 г меди. Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Ответ: 97,3 %.
434. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе расплавов и водных растворов NaCl и КОН. Сколько литров (н.у.) газа выделится на аноде при электролизе гидроксида калия, если электролиз проводить в течение 30 мин при силе тока 0,5А? Ответ: 0,052 дм3.
435. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора КВr. Какая масса вещества выделяется на катоде и аноде, если электролиз проводить в течение 1 ч 35 мин при силе тока 15 А? Ответ: 0,886 г; 70,79 г.
436. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора СиCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 см3 газа (н.у.). Ответ: 1,588 г.
437. При электролизе соли трехвалентного металла при силе тока 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла. Ответ: 114,82.
438. При электролизе растворов МgSO4 и ZnCl2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Какая масса вещества выделится на другом катоде; на анодах? Ответ: 8,17 г; 2,0 г; 8,86 г.
439. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора Na2SO4. Вычислите массу вещества, выделяющегося на катоде, если на аноде выделяется 1,12 дм3 газа (н.у.). Какая масса Н2SO4 образуется при этом возле анода? Ответ: 0,2 г; 9,8 г.
440. При электролизе раствора соли кадмия израсходовано 3434 Кл электричества, выделилось 2 г кадмия. Чему равна молярная масса эквивалента кадмия? Составьте электронные уравнения процессов, происходящих на угольных электродах.Ответ: 56,26 г/ моль.
441. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1ч 15мин 20с на аноде выделилось 6,4 г газа? Сколько литров газа (н.у.) выделилось при этом на катоде?
Ответ: 17,08 А; 8,96 дм3.
442. Вычислите массу серебра, выделившегося на катоде при пропускании тока силой 6А через раствор нитрата серебра в течение 30 минут. Составьте электронные уравнения процессов, происходящих на угольных электродах. Ответ: 12 г.
443. Определите массу вещества, выделяющегося на катоде при пропускании тока 13 А через раствор сульфата железа (II) в течение 1 часа, если выход вещества по току равен 70%. Составьте электронные уравнения процессов, происходящих на угольных электродах.
444. Найдите объем кислорода (н.у.), который выделится при пропускании тока силой 6А в течение 30 минут через водный раствор КОН. Составьте электронные уравнения процессов, происходящих на угольных электродах. Ответ: 627 см3.
445. Найдите объем водорода (н.у.), который выделится при пропускании тока силой 3А в течение 1ч через водный раствор Н2SO4. Составьте электронные уравнения процессов, происходящих на угольных электродах. Ответ: 1,25 дм3.
446. Определите время, необходимое для полного выделения вещества на катоде при электролизе 250 мл 6 %-ного раствора нитрата ртути (II) (ρр-ра = 1,09 г/см3). Сила тока 6 А. Выход по току 91%. Составьте электронные уравнения процессов, происходящих на угольных электродах.
447. При электролизе водного раствора Cr2(SO4)3 током силой 2А масса катода увеличилась на 8 г. В течение какого времени проводили электролиз? Составьте электронные уравнения процессов, происходящих на угольных электродах. Ответ:6,19 ч.
448. При электролизе водного раствора SnCl2 на аноде выделилось 4,48 дм3 хлора (н.у.). Составьте электронные уравнения процессов, происходящих на угольных электродах. Найдите массу выделившегося на катоде олова. Ответ: 23,7 г.
449. Какие вещества и в каком количестве будут выделяться на электродах при электролизе расплава MgCl2 в течение 2,5 часов при токе силой 6 А? Составьте схему электролиза. Ответ: 6,72 г; 6,27 дм3.
450. Вычислите молярную массу эквивалента двухвалентного металла и назовите его, если известно, что при электролизе раствора хлорида этого металла в течение 2 часов при токе силой 2,5 А выделилось 19,33 г металла. Составьте схему электролиза соли.
Ответ: 258,67 г/моль.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 2761; Нарушение авторских прав?; Мы поможем в написании вашей работы!