
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Схема данного гальванического элемента
|
|
|
|
Схема данного гальванического элемента
(-)А: Мg | Мg2+ || Zn2+ | Zn:К(+).
Вертикальная черта обозначает поверхность раздела между металлом и раствором, а две черточки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал –2,37В и является анодом, на котором протекает окислительный процесс: А(-): Мg – 2ē = Мg2+. (1)
Цинк, потенциал которого –0,763 В, - катод, т.е. электрод, на котором протекает восстановительный процесс:
К(+): Zn2+ + 2ē = Zn. (2)
Уравнение окислительно-восстановительной реакции, которая лежит в основе работы данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов: Мg + Zn2+ = Мg2++ Zn.
Для определения электродвижущей силы гальванического элемента (ЭДС ГЭ) из потенциала катода следует вычесть потенциал анода. Так как концентрации солей в растворах равны 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
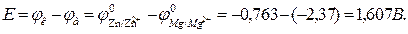
Контрольные задания
391. Составьте схему и вычислите ЭДС гальванического элемента, образованного серебряным электродом, погруженным в раствор AgNO3 с концентрацией Ag+, равной 0,01 моль/дм3, и стандартным водородным электродом. Напишите уравнения электродных процессов.
392. Что является окислителем и что восстановителем в гальваническом элементе, составленном из олова и серебра, погруженных в одномолярные растворы своих солей? Составьте схему соответствующего гальванического элемента, вычислите ЭДС. Изменится ли значение ЭДС, если растворы солей разбавить в 10 раз?
393. В два сосуда с голубым раствором медного купороса поместили: в первый – цинковую пластинку, а во второй – серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярное уравнения соответствующих реакций.
394. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) СuSO4; б) МgSO4; в) Рb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
395. При какой концентрации ионов Zn2+, в моль/л, потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала. Ответ: 0,30 моль/л.
396. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) АgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
397. Марганцевый электрод в растворе его соли имеет потенциал –1,23В. Вычислите концентрацию ионов Mn2+ в моль/л.
Ответ: 1,89∙10-2 моль/л.
398. Потенциал серебряного электрода в растворе AgNO3 составил 95% от величины его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ в моль/л. Ответ: 0,20 моль/л.
399. Составьте схему гальванического элемента, в котором роль анода выполнял бы стандартный водородный электрод. Напишите уравнения реакций, протекающих на аноде и катоде. Вычислите стандартную ЭДС этого элемента, а также ЭДС в том случае, когда концентрация ионов металла в растворе его соли равна 0,1 моль/дм3.
400. Электроды из марганца опущены в растворы KNO3, CrCl3, Pb(NO3)2, MgSO4. Укажите, в каких случаях будут протекать химические реакции. Составьте электронные уравнения.
401. Никелевый и кобальтовый электроды опущены соответственно в растворы Ni(NO3)2 и Co(NO3)2. В каком соотношении должны быть концентрации ионов этих металлов, чтобы потенциалы обоих электродов были одинаковыми? Ответ:СNi2+: CCo2+ ≈ 0,117.
402. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
403. При какой концентрации ионов Cu2+ в моль/л значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 3∙10-12 моль/л.
404. Какой гальванический элемент называется концентрированным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных первый – в 0,01н, а второй – в 0,1н растворы AgNO3. Ответ: 0,058 В.
405. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001М растворе, а другой такой же электрод – в 0,01М растворе сульфата никеля. Ответ: 0,029 В.
406. В каком направлении будут перемещаться электроны во внешней цепи при работе такого гальванического элемента:
Ag|Ag+(0,1М)||Ag+(0,01М)|Ag. Напишите электронные уравнения процессов, укажите анод и катод, рассчитайте значение ЭДС. Как называются гальванические элементы, электроды которых изготовлены из одного и того же металла?
407. Составьте схемы двух гальванических элементов, в одном из которых железо является анодом, а в другом – катодом. Напишите электронные уравнения процессов, происходящих на электродах. Рассчитайте стандартные ЭДС элементов.
408. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] =[Mg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,233 В.
409. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
410. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
411. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрациями [Mg2+] = [Cd2+] = 1 моль/л. Изменится ли величина ЭДС ГЭ, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В; не изменится.
412. Электродный потенциал кадмиевого электрода, погруженного в раствор соли кадмия, составляет –0,46 В. Составьте гальванический элемент, анодом которого является кадмиевый электрод, рассчитайте концентрацию ионов кадмия в растворе соли.
413. Процессы, протекающие на электродах при работе гальванического элемента, выражены следующими уравнениями: Cd0 - 2e → Cd2+; Hg2+ +2e → Hg0. Составьте схему элемента, напишите уравнение происходящей реакции. Вычислите ЭДС, зная, что концентрации ионов металлов в растворах их солей равны 0,1 моль/дм3.
414. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой должна быть концентрация ионов железа, чтобы ЭДС предложенного элемента стала равной нулю, если [Zn2+] = 0,001 моль/л?
Ответ: 1,28 · 10-14 моль/л.
415. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению: Ni + Pb(NO3)2 = Ni(NO3)2 + Pb. Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01 моль/л,[Pb2+] = 0,0001 моль/л. Ответ: 0,066 В.
416. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
417. Составьте схемы двух гальванических элементов, образованных электродами из алюминия и меди в паре со стандартным водородным электродом. Чем, катодом или анодом, являются электроды из Al и Cu в этих гальванических элементах? Рассчитайте значения стандартных ЭДС элементов, укажите процессы, протекающие на электродах.
418. Составьте схему гальванического элемента, при работе которого протекает следующая реакция: Zn+Cu2+=Zn2++Cu. Напишите электронные уравнения процессов, протекающих на электродах, вычислите ЭДС, если концентрации ионов Zn2+ и Cu2+ равны 0,01 моль/дм3 и 0,1 моль/дм3 соответственно.
419. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
420. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 8110; Нарушение авторских прав?; Мы поможем в написании вашей работы!