
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні властивості
|
|
|
|
Для спиртів характерні реакції за участю зв’язку О−Н, зв’язку С−О і окисні реакції. Присутність у молекулі спирту кратних зв’язків або ароматичного радикала не змінює принципово хімічні властивості гідроксильної групи, а надає спиртам властивостей, характерних для ненасичених або ароматічних сполук.
1. Кислотно-основні властивості
Спирти виявляють слабкі кислотні та слабкі основні властивості, тобто вони є амфотерними речовинами.
1.1. Кислотні властивості
Їх кислотні властивості зумовлені рухливістю атома водню гідроксильної групи. Атом кисню як більш електронегативного елементу зміщує електронну густину зв’язку О−Н на себе, утворюючи при цьому на атомі водню частковий позитивний заряд. Під дією сильних основ спирти відщеплюють від гідроксильної групи протон, тобто виявляють властивості ОН-кислот. Проте спирти є слабшими ОН-кислотами, ніж вода. Це зумовлене + І -ефектом вуглеводневого радикала, зв’язаного з гідроксильною групою. Додаткове збільшення електронної густини на атомі кисню за рахунок + І -ефекту вуглеводневого радикала приводить до зменшення полярності зв’язку О−Н і відповідно рухливості атома водню. Тому при переході від первинних спиртів до третинних кислотні властивості знижуються:
Н®ОН > CH3®ОН > (CH3)2CH®ОН…
Спирти як кислоти реагують з лужними металами, утворюючи алкоголяти:
2C2H5 −OH + 2Na ® 2C2H5 −ONa + Н2.
етилат натрію, етоксид натрію
У спиртовому середовищі алкоголяти піддаються іонізації з утворенням алкоксид-аніона, який виявляє сильні нуклеофільні та сильні основні властивості:
RO Na ® R − О− + Na+.
алкоксид натрію алкоксид-аніон
У зв’язку з цим алкоголяти широко використовуються в органічному синтезі як сильні основи та сильні нуклеофільні реагенти. Алкоголяти легко розкладаються водою до вихідних спиртів. Це підтверджує, що спирти є більш слабкими кислотами, ніж вода.
Через низьку кислотність спирти майже не вступають у реакцію з лугами.
1.2. Основні властивості
Основні властивості спиртів зумовлені наявністю на атомі кисню гідроксильної групи неподіленої пари електронів, здатної до приєднання протону. Так, з сильними кислотами первинні спирти утворюють на холоді нестійкі солі алкілоксонію:
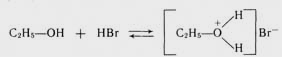
етилоксонію бромід
У багатьох реакціях за участю спиртів алкоксонієві солі утворюються як проміжні продукти.
У порівнянні з кислотними, основні властивості спиртів змінюються в протилежному порядку, тобто при переході від первинних до третинних спиртів основні властивості зростають.
1.3. Взаємодія з мінеральними та органічними кислотам
Спирти реагують з мінеральними кислотами (сульфатною, нітратною, нітритною та ін.) та органічними кислотами з утворенням естерів (складних ефірів). Ця реакція дістала назву реакції етерифікації (від лат. aether − ефір):
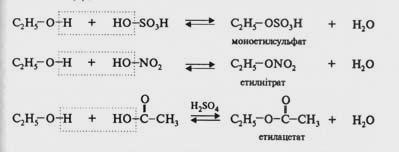
Реакція етерифікації оборотна. Для зміщення рівноваги праворуч або беруть надлишок одного з реагентів (звичайно спирту), або видаляють один з продуктів реакції. Взаємодія спиртів з карбоновими кислотами проходить в присутності каталізатора, найчастіше з концентрованою H2SO4. Реакції спиртів з карбоновими кислотами відбуваються за механізмом нуклеофільного заміщення. Молекула води, яка виділяється в процесі взаємодії, утворюється за рахунок атома водню групи −ОН спирту та гідроксильної групи карбонової кислоти.
2. Дегідратація спиртів
При нагріванні спиртів у присутності концентрованих H2SO4, Н3РО4 або при пропусканні пари спирту над каталізатором − А12О3 спирти відщеплюють воду, тобто піддаються дегідратації. У залежності від природи спирту та умов проведення реакція дегідратації може проходити міжмолекулярно та внутрішньомолекулярно.
При міжмолекулярній дегідратації спиртів утворюються прості ефіри (етери):
С2Н5 −О−Н + Н −О− С2Н5 ® С2Н5 −О−С2Н5 + Н2О.
діетиловий ефір
У результаті внутрішньомолекулярної дегідратації утворюються алкени:
СН3− CH2− OH ® CH2=CH2 + H2О.
етилен
У несиметричних спиртах відщеплення води відбувається за правилом Зайцева, тобто водень відходить від сусіднього, менш гідрогенізованого атома вуглецю:
СН3− CH2− CH2(OH) −CH3 ® СН3− CH = CH2 −CH3 + Н2О.
бутанол-2 бутен-2
Міжмолекулярна та внутрішньомолекулярна дегідратації спиртів є конкуруючими процесами. Міжмолекулярна дегідратаціястає переважним процесом при нагріванні спиртів у присутності каталітичних кількостей мінеральної кислоти (спирт у надлишку) при температурі 140—160 °С. Внутрішньомолекулярна дегідратація,тобто перетворення спирту на алкен, відбувається при нагріванні спиртів з надлишком мінеральної кислоти при температурі вище 170 °С. Особливо легко вона проходить у третинних спиртів.
У випадку пропускання пари спирту над А12О3 при температурі 200−250 °С відбувається міжмолекулярна дегідратація з утворенням простих етерів, а за більш високих температур (300−400 °С) проходить внутрішньомолекулярна дегідратація, тобто утворюються алкени.
Міжмолекулярна дегідратаціяспиртів проходить за механізмом SN 2або SN 1. Подібно до галогеналканів, первинні спирти вступають у реакцію міжмолекулярної дегідратації, як правило, за механізмом SN 2, третинні − за SN 1, вторинні можуть реагувати як за SN 2, так і за SN 1 − механізмами.
Внутрішньомолекулярна дегідратаціяспиртів, в залежності від їх будови, може проходити за механізмами Е 1 і Е 2. При цьому первинні спирти реагують у більшості випадків за механізмом Е 2, а вторинні, та особливо третинні − за механізмом Е 1.
3. Взаємодія з галогеноводневими кислотами
При взаємодії спиртів з галогеноводневими кислотами (НСІ, НВг, НІ) гідроксильна група заміщується на атом галогену та утворюються гало-геналкани. Реакція є оборотною. Для зміщення рівноваги праворуч звичайно з реакційного середовища відганяють воду або галогеналкан:
С2Н5 −ОН + НІ «С2Н5 − І + Н2О.
За реакційною здатністю зі спиртами галогеноводневі кислоти розташовуються в ряд: НС1 < НВr < НІ. З йодоводневою та бромоводневою кислотами реакція проходить легко, з хлороводневою − значно важче. Первинні та вторинні спирти реагують з хлороводневою кислотою тільки в присутності хлориду цинку (кислота Льюїса).
Реакційна здатність спиртів у відношенні до галогеноводневих кислот зменшується в ряду:
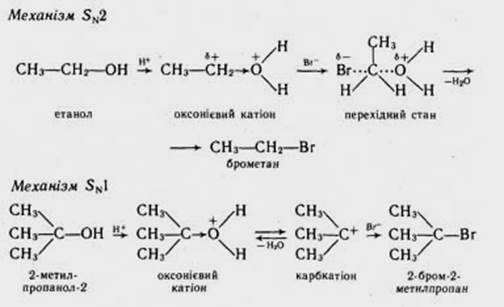
бензиловий − аліловий − третинні − вторинні − первинні спирти. З первинними спиртами реакція проходить, як правило, за механізмом SN 2, з третинними − за SN 1. Вторинні спирти реагують за механізмами як SN 1, так і SN 2. Нижче подані схеми взаємодії спиртів з бромоводневою кислотою за механізмами SN 2 і SN 1.
4. Окиснення
Первинні, вторинні та третинні спирти по-різному відносяться до дії окисників. Первинні спирти при окисненні спочатку утворюють альдегіди, які окиснюються далі, перетворюючись при цьому на карбонові кислоти:
С2Н5ОН + [О] ® СН3−СОН + Н2О.
Вторинні спирти при окисленні утворюють кетони:
СН3 − СН(ОН) − СН3 + [О] ® СН3 − СО − СН3 + Н2О.
ацетон
Третинні спирти стійкі до окиснення, за жорстких умов вони окиснюються з розривом карбонового ланцюга та утворенням суміші кетонів та карбонових кислот.
Як окисники для окиснення спиртів використовують оксид хрому (VI), біхромат калію в сульфатній кислоті (хромова суміш), перманганат калію в сульфатній кислоті та ін.
У промисловості для окиснення первинних спиртів в альдегіди використовують метод каталітичного дегідрування. Суть методу полягає в пропусканні пари спирту над каталізатором (дрібно-подрібнена мідь) при 280−300 °С. При цьому відбувається відщеплення молекули водню від молекули спирту та утворюється альдегід. Перевагою каталітичного гідрування є більш глибоке окиснення альдегіду до кислоти.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 2119; Нарушение авторских прав?; Мы поможем в написании вашей работы!