
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоёмкость. Определение и выражение теплоемкости
|
|
|
|
Теплоемкостью какого-либо тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один кельвин. Если сообщение телу количества тепла dQ повышает его температуру на dT, то теплоемкость по определению равна:
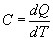 (1).
(1).
Молярной теплоемкостью называют теплоемкость одного моля газа, а удельной теплоемкостью — теплоемкость единицы массы газа.
Теплоемкость газа, находящегося в постоянном объеме, называется теплоемкостью при постоянном объеме (Cv), а газа, находящегося при постоянном давлении — теплоемкостью при постоянном давлении (Cp).
Если нагревание происходит при постоянном объеме, тело не совершает работы над внешними телами и, следовательно, согласно первому началу термодинамики, все тепло идет на приращение внутренней энергии тела:
dQv=dU (2).
Из (2) вытекает, что теплоемкость любого тела при постоянном объеме равна:
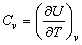 (3).
(3).
Известно, что внутренняя энергия произвольной массы газа m будет равна:
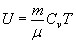 (4).
(4).
Если нагревание газа происходит при постоянном давлении, то газ будет расширяться, совершая над другими телами положительную работу. Следовательно, для повышения температуры газа на один кельвин в этом случае понадобится больше тепла, чем при нагревании при постоянном объеме, так как часть тепла будет затрачиваться на совершение работы. Поэтому теплоемкость при постоянном давлении больше чем теплоемкость при постоянном объеме.
Напишем уравнение первого начала термодинамики для моля газа:
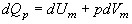 (5).
(5).
В данном случае тепло сообщается газу в условиях, когда давление постоянно. В уравнении (5) на это указывает индекс р при Q. Разделив уравнение (4) на dT, получим выражение для молярной теплоемкост газа при постоянном давлении:
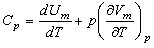 (6).
(6).
Величина 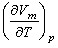 представляет собой приращение объема моля газа при повышении температуры на один кельвин, получающееся в случае, когда р постоянно. Из уравнения состояния известно, что
представляет собой приращение объема моля газа при повышении температуры на один кельвин, получающееся в случае, когда р постоянно. Из уравнения состояния известно, что 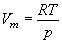 . Дифференцируя это выражение по Т, полагая р = const, находим:
. Дифференцируя это выражение по Т, полагая р = const, находим:
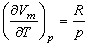 (7).
(7).
Подставив данный результат в (6), получим
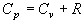 (8).
(8).
Таким образом, работа, которую совершает моль идеального газа при повышении его температуры на один кельвин при постоянном давлении, оказывается равной газовой постоянной R. Отметим, что соотношение (8) получено с использованием уравнения состояния идеального газа, и справедливо только для идеального газа.
Величина 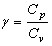 представляет собой характерную для каждого газа величину. Для одноатомных газов это отношение близко к 5/3, для двухатомных — к 7/5, для трехатомных — к 4/3.
представляет собой характерную для каждого газа величину. Для одноатомных газов это отношение близко к 5/3, для двухатомных — к 7/5, для трехатомных — к 4/3.
Из уравнения (8) получим:
 (9).
(9).
Используя выражение (9) можно получить выражение для определения внутренней энергии идеального газа:
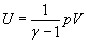 (10).
(10).
Рассмотрим процесс, в уравнении которого фигурирует отношение теплоемкостей 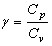 , называемый адиабатическим. Адиабатический процесс — это процесс, протекающий без теплообмена с внешней средой. Наиболее близкими к адиабатическому являются быстропротекающие процессы. Найдем уравнение, связывающее параметры состояния для идеального газа. Для этого запишем первое начало термодинамики для адиабатического процесса
, называемый адиабатическим. Адиабатический процесс — это процесс, протекающий без теплообмена с внешней средой. Наиболее близкими к адиабатическому являются быстропротекающие процессы. Найдем уравнение, связывающее параметры состояния для идеального газа. Для этого запишем первое начало термодинамики для адиабатического процесса 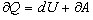 и поскольку
и поскольку 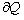 равно нулю, то:
равно нулю, то:
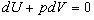
следовательно  (11).
(11).
Воспользуемся уравнением Менделеева-Клапейрона:
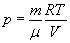 (12).
(12).
Подставим (12) в уравнение (11). Получим:
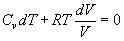 , иначе
, иначе 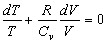 (13).
(13).
Иначе 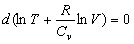
Значит 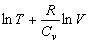 = const.
= const.
Или 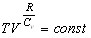
 по-иному
по-иному 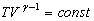 (14).
(14).
Заменив Т на
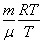 ,
,
получаем соотношение 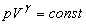 (15), называемое уравнением Пуассона.
(15), называемое уравнением Пуассона.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1527; Нарушение авторских прав?; Мы поможем в написании вашей работы!