
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия рабочего тела
|
|
|
|
Внутренняя энергия любого физического тела относится к фундаментальным свойствам материи, из которой состоит это тело. Она определяется как функция параметров состояния и поэтому называется функцией состояния.
Внутренняя энергия на основании кинетической теории реального газа включает в себя:
-кинетическую энергию поступательного, вращательного и колебательного
движения частиц;
-потенциальную энергию взаимодействия частиц
-энергию электронных оболочек атомов;
-внутриядерную энергию.
В большинстве теплоэнергетических процессов две последние составляющие остаются неизменными. Поэтому в дальнейшем под внутренней энергией газа будем понимать энергию хаотического движения молекул и атомов, включающую кинетическую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного вида, а также потенциальную энергию сил парных взаимодействия между молекулами.
Кинетическая энергии молекул является функцией температуры, значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, является функцией удельного объема v. Внутренняя энергия U идеального газа, в котором отсутствуют силы взаимодействия между молекулами, не зависит от объема газа или давления, а определяется только его температурой.
Значение потенциальной энергии, возникающей при парном взаимодействии молекул, зависит от среднего расстояния между молекулами и, следовательно, является функцией удельного объема v.
Внутренняя энергия U идеального газа, в котором отсутствуют силы взаимодействия между молекулами, не зависит от объема газа или давления, а определяется только его температурой.
При Т = 0 в атомах сохраняется только движение электронов и вн. энэ. при этом называется нулевой внутренней энергией.
Таким образом, полную внутреннюю энергию можно представить:
U = UКИН+ UП0T + U0, [Дж],
где UКИН и UП0T - внутренняя кинетическая и потенциальная энергии молекул;
Uо - внутренняя энергия тела при температуре абсолютного нуля.
Таким образом, при Т = 0 кинетическая и потенциальная энергия
теплового движения молекул равна нулю, но энергия нетеплового происхождения остаётся (движение электронов, внутриядерные процессы и т. д.).
В термодинамике изучаются только явления теплового происхождения, поэтому принимается, что Uo = 0.
С помощью уравнения состояния можно уравнение Uвыразить через любые два параметра, т.е.
U= f(P,T) или
U= f(P, v) или
U= f(v, T).
Если эти выражения продифференцировать, то получим, что Uявляется полным дифференциаломлюбых двух параметров состояния, например
dU= PdT+ TdPили
dU= vdT+ Tdv.
Этим свойством она отличается от работы (и от теплоты, как будет показано ниже), которая не является функцией состояния системы,
Для сложной системы, состоящей из смеси газов, она определяется суммой энергий отдельных частей, т. е. обладает свойством аддитивности.
|
Поскольку Uявляется полным дифференциалом параметров состояния, то и внутренняя энергия будет являться параметром состояния системы:
U= f(P, v, T) [Дж].
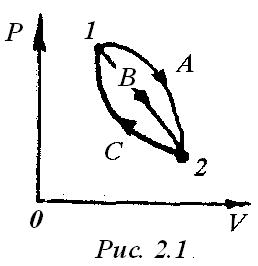
Изменение Uв термодинамическом процессе не зависит от характера пути (А, В или С), а определяется только начальным и конечным состоянием процесса в точках 1 и 2 (рис.2.1), т.е.
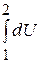 = f2 (Р2, v2, Т2) – f1 (Р1, v1, Т1).=
= f2 (Р2, v2, Т2) – f1 (Р1, v1, Т1).=  .
.
В круговых процессах изменение удельной внутренней энергииравно нулю.
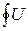 = 0.
= 0.
Молекулярно-кинетической теорией газов доказано, что поскольку в идеальном газе нет взаимодействия между молекулами, то внутренняя энергия не зависит от Р иv, а является только функцией от температуры:
u ИД.ГАЗА = f(T).
В отличие от внутренней энергии функции тепла или работы не является полными дифференциалами и потому при осуществлении процесса определяются не только начальными и конечными значениям функции, но и учитывают характер процесса (т.е изменение параметров состояния).Вследствие этого
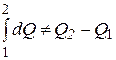 и
и
. 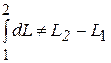 .
.
Внутренняя энергия, отнесённая к единице массы, называется удельной внутренней энергией, u = U / m [Дж / кг].
Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических процессах. Поэтому начало отсчета внутренней энергии может быть выбрано произвольно.
Например, в соответствии с международным соглашением для воды за нуль принимается значение внутренней энергии при температуре 0,01 °С и давление насыщенного водяного пара при этой температуре 610,8 Па, а для идеальных газов—при О °С вне зависимости от давления.
В дальнейшем для краткости будем называть величину и просто внутренней энергией.
Дифференциал внутренней энергии равен
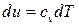 ,
,
где cv – истинная удельная массовая теплоёмкость при постоянном объёме, Т – температура рабочего тела.
В практических расчётах приращение внутренней энергии определяется формулой
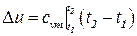
где 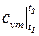 - средняя теплоёмкость при постоянном объёме в интервале температур t1 и t2.
- средняя теплоёмкость при постоянном объёме в интервале температур t1 и t2.
23. Относительная и абсолютная влажности воздуха.
Вес, или точнее масса, водяного пара, содержащегося в 1 м3 воздуха, называется абсолютной влажностью воздуха. Другими словами, это плотность водяного парав воздухе. При одной и той же температуре воздух может поглотить вполне определенное количество водяного пара и достичь состояния полного насыщения. Абсолютная влажность воздуха в состоянии его насыщения носит название влагоемкости.
Величина влагоемкости воздуха резко возрастает с увеличением его температуры. Отношение величины абсолютной влажности воздуха при данной температуре к величине его влагоемкости при той же температуре называется относительной влажностью воздуха.
Для определения температуры и относительной влажности воздуха пользуются специальным прибором — психрометром. Психрометр состоит из двух термометров. Шарик одного из них увлажняется с помощью марлевого чехла, конец которого опущен в сосуд с водой. Другой термометр остается сухим и показывает температуру окружающего воздуха. Смоченный термометр показывает температуру более низкую, чем сухой, так как испарение влаги из марли требует определенного расхода тепла. Температура смоченного термометра носит название предела охлаждения. Разность между показаниями сухого и смоченного термометров называетсяпсихрометрической разностью.
Между величиной психрометрической разности и относительной влажностью воздуха имеется определенная зависимость. Чем больше психрометрическая разность при данной температуре воздуха, тем меньше относительная влажность воздуха и тем больше влаги может поглотить воздух. При разности равной нулю воздух насыщенводяным паром и дальнейшего испарения влаги в таком воздухе не происходит.
Абсолютная влажность
Абсолютная влажность воздуха (f) — это количество водяного пара, фактически содержащегося в 1м3 воздуха:
f = m (масса содержащегося в воздухе водяного пара)/ V (объём влажного воздуха)
Обычно используемая единица абсолютной влажности: (f) = г/м3
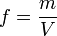
Относительная влажность
Относительная влажность: φ = (абсолютная влажность)/(максимальная влажность)
Относительная влажность обычно выражается в процентах. Эти величины связаны между собой следующим отношением:
φ = (f×100)/fmax
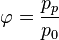
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 957; Нарушение авторских прав?; Мы поможем в написании вашей работы!