
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гибридизация и гибридные орбитали
|
|
|
|
Химические связи и пространственная форма молекул.
СОБИРАТЕЛЬНЫЕ ТРУБОЧКИ
Все органические соединения содержат атом углерода, который может быть связан с другим атомом углерода, с водородом или с гетероатомами - кислородом, серой, азотом. Отсутствие диссоциации на ионы у большинства органических соединений заставляет предполагать, что в органических молекулах связь ковалентная. Ковалентная связь образуется либо за счёт обобществления неспаренных электронов с антипараллельными спинами, ранее принадлежавших разным атомам (обменный механизм), либо за счёт неподелённой пары электронов, которую один атом (донор) отдаёт другому атому (акцептору) на свободную орбиталь последнего
А • + ۰В А •۰В
Обменный механизм: (прямыми стрелками показаны спины электронов.)
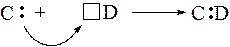
Донорно-акцепторный механизм (• и ۰ - электроны.)
Ковалентная связь, образованная по донорно-акцепторному механизму,по своим свойствам ничем не отличается от обычной ковалентной связи.
Установлено, что химические явления связаны с процессами, происходящими в электронной оболочке атомов. С современной точки зрения, электрон представляют в виде электронного облака.
Существует четыре типа электронных облаков – s, p, d, f.
s-облако имеет форму сферы, в центре которой находится ядро.
p-облако - форму "гантели", (форму двух эллипсоидов, между которыми находится атомное ядро).
d- и f -облака имеют сложную конфигурацию, а так как в образовании связей в органических соединениях эти облака участвуют редко, мы их рассматривать не будем.
Как уже было отмечено выше, в образовании химических связей принимают участие неспаренные электроны или неподеленные пары электронов, в случае образования донорно-акцепторной связи.
Однако, довольно часто число неспаренных электронов, имеющихся у атома данного элемента, меньше числа связей, которые он образует с другими элементами. Так, у атома углерода два неспаренных электрона, а его обычная валентность равна четырём.
Чтобы согласовать электронное строение атома с его валентностью, используют представление о возбуждении атома.
Возбуждение - это переход электрона с одного подуровня на другой в пределах валентного энергетического уровня.
С 1s22s22p2
 два неспаренных электрона в стационарном состоянии
два неспаренных электрона в стационарном состоянии

четыре неспаренных электрона в возбуждённом состоянии
Однако эти четыре электрона неодинаковы по своему состоянию: один электрон имеет сферическую форму электронного облака (s -состояние), а три электрона - форму гантели (р -состояние). В этом случае можно было бы ожидать, что даже в самом простом соединении - в метане - связи должны быть неравноценны: одна связь должна отличаться от трёх других формой перекрывающихся орбиталей, а, следовательно, и энергией. Но экспериментально было
доказано, что все четыре связи углерода с водородом равноценны.
Чтобы согласовать теоретические представления с опытными данными, Л.Полинг ввёл представление о гибридизации атомных орбиталей как о своеобразном "смешении" шаровой и гантеливидных орбиталей. В результате такой комбинации атомных орбиталей получаются гибридные орбитали, которые имеют одинаковую форму и равный запас энергии.
Для атома углерода возможны три валентных состояния с различными типами гибридизации.
Первое валентное состояние - sp3 -гибридизация
В гибридизации участвуют одна s-орбиталь и три р-орбитали, в результате чего образуются четыре sp3 –гибридных орбитали, которые расположены в пространстве относительно друг друга под углом 109028’ и направлены из центра правильного тетраэдра к его вершинам. 1s + 3p = 4 sp3 ∠ 109028′ 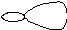
В отличие от негибридизованных s- и р- орбиталей sp3 -гибридные орбитали имеют одну большую долю («передняя доля»), которая хорошо образует связи, и малую долю («задняя доля»),которую иногда даже не рисуют, хотя она и играет небольшую роль в образовании связей в некоторых реакциях. sp3-Гибридные орбитали принимают участие в образовании только σ -связей.
σ -связь - это одинарная связь между атомами, на образование которой затрачивается одна пара электронов, и максимальное перекрывание электронных орбиталей происходит по прямой, соединяющей ядра атомов.
Рассмотрим строение σ-связей 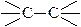 и
и 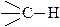 , которые встречаются в насыщенных углеводородах.
, которые встречаются в насыщенных углеводородах.
σ -связь 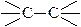 образована sp3 –гибридными орбиталями атома углерода, σ-связь
образована sp3 –гибридными орбиталями атома углерода, σ-связь 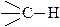 - sp3 –орбиталью атома углерода и s-орбиталью атома водорода.
- sp3 –орбиталью атома углерода и s-орбиталью атома водорода. 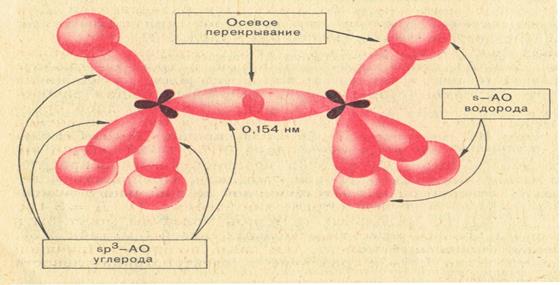
Особенности σ-связи 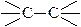 :
:
1. связь прочная, Е = 83,6 ккал\моль; (348 кДж \ моль)
2. самая длинная связь l = 0,154нм;
3. связь труднополяризуемая;
4. вокруг σ-связи есть свободное вращение.
Второе валентное состояние атома углерода –sp2-гибридизация
В гибридизации участвуют одна s-орбиталь и две р-орбитали, в результате образуются три гибридных орбитали, которые лежат в одной плоскости под углом в 1200.
1s + 2p = 3 sp2  1200. sp2- гибридные орбитали отличаются от sp3-гибридных орбиталей меньшим размером задней доли.
1200. sp2- гибридные орбитали отличаются от sp3-гибридных орбиталей меньшим размером задней доли.
При sp2-гибридизации у атома углерода осталась одна негибридизованная р-орбиталь, которая, ориентирована перпендикулярно плоскости гибридных орбиталей.
sp2-Орбитали участвуют в образовании σ-связи, а р-орбитали - в образовании π-связи. Эта связь образуется при перекрывании р-орбиталей, оси которых параллельны, над и под плоскостью σ-связей. π-Связь как самостоятельная связь не существует, она всегда бывает в комбинации с σ-связью и входит в состав двойных и тройных связей.
Перекрывание sp2- и р – орбиталей, приводящее к образованию связей в молекуле этилена, представлено на следующем рисунке.
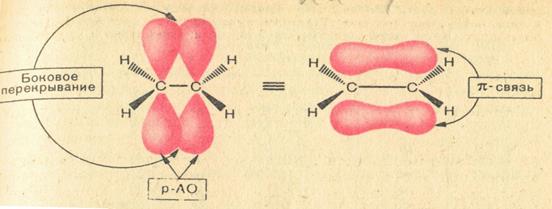
Особенности двойной связи
1. Двойная связь неоднородна, она состоит из одной σ-связи и одной π -связи. В химических превращениях в первую очередь разрывается
π -связь, так как она слабее σ - связи.
2. Е 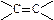 связи = 146,5ккал\моль (620 кДж\моль.)
связи = 146,5ккал\моль (620 кДж\моль.)
3. Двойная связь короче одинарной, l =0,135нм.
4. Связь легко поляризуема
5. При наличии двойной связи в молекуле прекращается вращение вокруг оси σ-связи; конфигурация алкена становится устойчиво плоской, что приводит к появлению цис- транс- изомеров.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1905; Нарушение авторских прав?; Мы поможем в написании вашей работы!