
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Взаимное влияние непосредственно связанных атомов
|
|
|
|
ИНДУКТИВНЫЕ И МЕЗОМЕРНЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛАХ.
В органической химии известно огромное число явлений, которые с несомненностью указывают на взаимное влияние атомов и групп атомов в молекулах. Отличают взаимное влияние непосредственно связанных атомов и влияние атомов, достаточно далеко отстоящих друг от друга.
Эта проблема напрямую связана с вопросами полярности и поляризуемости связей.
Полярность связи определяетсяэлектроотрицательностью атомов, образующих связь. Чем больше разность электроотрицательностей связанных атомов, тем полярнее связь. Так, например, полярность связи 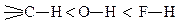 .
.
Следует отметить, что электроотрицательность (способность атома притягивать к себе электроны) и электроноакцепторные или электронодонорные свойства элемента - это не одно и то же.
Элемент может иметь большую величину электроотрицатель-ности, но при этом в ряде реакций проявлять себя донором электро-нов. Так, например, фтор – самый электроотрицательный элемент, в соединении CH3→ F является исключительно акцептором электронов, а в соединении
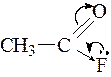
проявляет и некоторые донорные свойства.
Поляризуемость связи - явление, связанное с увеличением реакционной способности связи за счёт более лёгкой её деформации.
Поляризуемость связи зависит:
а) от радиусов атомов, образующих данную связь. Чем больше радиус атома, тем более "рыхлая" электронная оболочка у данного атома и тем легче она деформируется. Так, например, связь I-I более легко поляризуема, чем связь Cl-Cl;
б) от электроотрицательности атомов, образующих связь. Чем больше электроотрицательность атома, тем более компактная у него электронная оболочка и тем труднее её деформировать;
в) от природы электронов, образующих данную связь.
Двойные и тройные связи, образованные π-электронами, поляризуются значительно легче, чем одинарные связи, образованные гибридными орбиталями.
Поляризуемость связи не зависит от её полярности
Так, например, двойная связь в молекуле этилена (СН2 =СН2) неполярна, но она легко поляризуема, а связь C- Cl значительно более полярна, чем связь C-I, но менее легко поляризуема.
Таким образом, полярность и поляризуемость связей - важный фактор, который необходимо учитывать при рассмотрении проблемы взаимного влияния атомов.
Взаимное влияние непосредственно связанных атомов можно рассмотреть на примере изменения химического характера атома водорода, связанного с углеродом, кислородом и фтором
Атом водорода, связанный с sp3-гибридизованным атомом углерода (связь 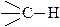 ), с большим трудом и далеко не во всех соединениях может замещаться на металл при действии щелочных металлов.
), с большим трудом и далеко не во всех соединениях может замещаться на металл при действии щелочных металлов.
Атом водорода, связанный с кислородом (связь О-Н) уже значительно более подвижен и может легко замещаться на металл при действии металлического натрия, а иногда и при действии щелочей.
Атом водорода, связанный с атомом фтора (связь H-F), очень подвижен. Связь H-F разрывается даже под действием воды. Причина различного химического характера водорода в связях
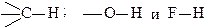 кроется в различной полярности этих связей.
кроется в различной полярности этих связей.
В этом ряду полярность связей элемент - водород меняется следующим образом:
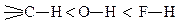 .
.
С другой стороны, высокая реакционная способность иодистых алкилов R—I (например, в реакциях нуклеофильного замещения) по сравнению с фтористыми, хлористыми и бромистыми алкилами, может быть целиком отнесена за счёт лёгкой поляризуемости связи C—I, поскольку в отличие от связей C—F; C—Cl и C—Br, эта связь практически неполярна.
3.2. Взаимное влияния атомов, непосредственно не
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 791; Нарушение авторских прав?; Мы поможем в написании вашей работы!