
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон возрастания энтропии. Обратимые и необратимые процессы
|
|
|
|
9.1. Возрастание энтропии - II начало термодинамики.
Пусть неравновесная замкнутая система обладает энергией 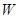 . Разобьем эту систему на квазизамкнутые макроскопические подсистемы с энергиями
. Разобьем эту систему на квазизамкнутые макроскопические подсистемы с энергиями 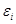 . Тогда
. Тогда
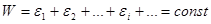 . (5.49)
. (5.49)
Малые подсистемы достигают равновесия быстрее, чем большие. Поэтому возможна ситуация, когда каждая из малых подсистем достигла своего равновесия, но между подсистемами равновесия еще нет. Большая система при этом не равновесна.
Макроскопическое состояние каждой квазизамкнутой равновесной подсистемы описывается вероятностью 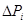 и может быть выражено через энтропию этой подсистемы
и может быть выражено через энтропию этой подсистемы 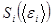 .
.
Рассматриваемое состояние всей неравновесной системы описывается вероятностью  , которая находится по теореме об умножении вероятностей как произведению всех
, которая находится по теореме об умножении вероятностей как произведению всех 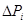 :
:
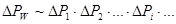 (5.50)
(5.50)
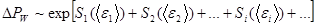 . (5.51)
. (5.51)
Здесь 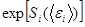 - быстро меняющаяся функция энергии
- быстро меняющаяся функция энергии 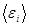 , а все остальные опущенные множители меняются слабо с энергией, и на фоне резкой экспоненциальной зависимости их можно считать постоянными.
, а все остальные опущенные множители меняются слабо с энергией, и на фоне резкой экспоненциальной зависимости их можно считать постоянными.
Нас интересует процесс установления равновесия между подсистемами, приводящий замкнутую систему в равновесие. Поэтому средние энергии подсистем 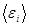 мы рассматриваем как переменные энергии, по которым устанавливается равновесие между подсистемами. Из выражения (5.51) следует, что наиболее вероятное равновесное состояние системы достигается при максимальном значении суммы энтропий подсистем, стоящих в показателе экспоненты. Т.о. если суммарная энтропия растет, то соответствующая вероятность
мы рассматриваем как переменные энергии, по которым устанавливается равновесие между подсистемами. Из выражения (5.51) следует, что наиболее вероятное равновесное состояние системы достигается при максимальном значении суммы энтропий подсистем, стоящих в показателе экспоненты. Т.о. если суммарная энтропия растет, то соответствующая вероятность  растет очень быстро.
растет очень быстро.
В рамках классической термодинамики нельзя получить информацию о скорости достижения равновесия (т.е. нельзя найти время релаксации). Однако можно установить общее направление процессов, которое приводит к росту вероятности. Процессы, связанные с уменьшением энтропии, маловероятны, т.к.  резко (по экспоненте) убывает.
резко (по экспоненте) убывает.
Вывод: если замкнутая макроскопическая система находится в неравновесном состоянии, то наиболее вероятным следствием для нее будет монотонное возрастание энтропии.
Закон возрастания энтропии для замкнутых систем – это второе начало термодинамики:
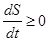 . (5.52)
. (5.52)
Второе началобыло введено сначала Клаузиусом, а затем вероятностное толкование закона возрастания энтропии было дано Больцманом (1870).
Здесь уместно процитировать Больцмана: всегда имеются флуктуационные состояния, соответствующие уменьшению энтропии, и поэтому чрезвычайно маловероятные. Вероятность их настолько мала, что для макроскопических тел эти флуктуации не наблюдаются.
Во всех имеющихся в природе замкнутых системах энтропия никогда самопроизвольно не убывает, она увеличивается или остается постоянной 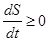 . Закон возрастания энтропии (5.52) устанавливает определенное направление течения процессов в природе.
. Закон возрастания энтропии (5.52) устанавливает определенное направление течения процессов в природе.
9.2. Обратимые и необратимые процессы.
Основываясь на законе возрастания энтропии все процессы, протекающие в макроскопических телах можно
 разделить на две группы.
разделить на две группы.
1) Процессы, сопровождающиеся возрастанием энтропии замкнутой
неравновесной системы, называются необратимыми.
Для таких процессов 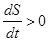 . Текущие в обратном направлении процессы
. Текущие в обратном направлении процессы
оказываются практически невозможными, т.к. они связаны с уменьшением энтропии.
Пример. Расширение газа в пустоту.

|
Пусть в одной половине сосуда, разделенного перегородкой, находится газ, а вторая половина сосуда вакууммирована. Если убрать перегородку, газ распространится на весь объем. В результате увеличения объема, занимаемого газом, увеличится число микроскопических состояний, реализующих любое из макроскопических состояний газа, т.е. энтропия возрастет. Самопроизвольный обратный процесс, при котором все молекулы газа соберутся в одной половине сосуда, практически невозможен, т.к. ему соответствует упорядоченное движение молекул газа в одну сторону, т.е. уменьшение беспорядка, ведущее к уменьшению энтропии.
Необратимыми являются все процессы в телах, сопровождающиеся потерями энергии на теплообмен с окружающей средой.
Примеры: процессы с трением, выделением джоулева тепла (ток идет через сопротивление), передача тепла от более горячего к более холодному.
2) Процессы, в которых энтропия замкнутой системы остается постоянной во времени, называются обратимыми.
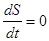 . (5.53)
. (5.53)
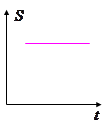 Квазистатические процессы – процессы бесконечно медленно протекающие
Квазистатические процессы – процессы бесконечно медленно протекающие
во времени, так что в каждый момент времени система находится в равновесии.
Поскольку в равновесном состоянии энтропия системы максимальна, то она и не
изменяется в ходе процесса.
Поэтому возможен квазистатический процесс, текущий в обратном направлении.
Пример квазистатического процесса: медленное движение поршня в цилиндре
 с газом. Можно вернуть систему в исходное
с газом. Можно вернуть систему в исходное
состояние, проходя ту же последовательность
равновесных состояний.
Идеальные квазистатические процессы, естественно невозможно реализовать, поскольку всегда имеются потери, связанные, например, с трением или другими причинами. Тем не менее, представление об идеализированных квазистатических процессах очень важно, т.к. дает возможность правильного качественного, а зачастую и с хорошим приближением количественного описания состояния газа, используя малое число параметров – 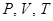 .
.
Если замкнутая система образована телом и окружающей его средой, то энтропия системы определяется как
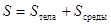 .
.
В ходе квазистатического процесса энтропия тела может убывать, но при этом энтропия среды должна возрастать так, чтобы суммарная энтропия 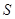 системы была постоянной:
системы была постоянной:
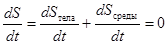 . (5.54)
. (5.54)
Квазистатический процесс можно реализовать и в теплоизолированном теле, в котором изменение состояния тела происходит под действием внешних сил. Такие процессы называются адиабатическими. Для адиабатических процессов
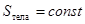 или
или 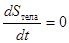 .
.
Поскольку нет теплообмена, не происходит и изменения энтропии. Реализация адиабатического процесса трудна, т.к. он должен быть достаточно медленным, чтобы удовлетворять условию квазистатичности, а с другой стороны - достаточно быстрым, чтобы исключить теплообмен с окружающей средой.
|
|
|
|
|
Дата добавления: 2015-05-29; Просмотров: 1615; Нарушение авторских прав?; Мы поможем в написании вашей работы!