
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розрахункові задачі. 1. Формула m=(Mr.Q)/n.F описує: а) потенціал металевого електроду, зануреного в розчин його солі; б) напругу розкладу речовини; в) закон Фарадея; г) закон Ома
|
|
|
|
Тестові завдання
1. Формула m=(Mr.Q)/n.F описує: а) потенціал металевого електроду, зануреного в розчин його солі; б) напругу розкладу речовини; в) закон Фарадея; г) закон Ома?
2. Силу струму в ланцюгу з електролізером можна розрахувати за формулою: а) I=(Ek-Ea)/R; б) E=E0+(0,059/nF).lgC; в) m=(Mr.Q)/n.F; г) m=kQ; д) E=mc2?
3. В кулонометричному аналізі в потенціостатичному режимі кількість електрики, що була витрачена на електроперетворення досліджуваної речовини можна визначити: а) як добуток Iел.tел; б) за збільшенням маси катоду паралельно підключеного срібного кулонометра; в) за зміною маси катоду послідовно підключеного мідного кулонометра.
4. При електрогравіметричному визначенні купруму для запобігання виділенню водню на катоді: а) до досліджуваного розчину додають NO3-; б) використовують катод у формі сітки; в) інтенсивно перемішують розчин; г) нагрівають розчин до кипіння.
5. При електрогравіметричному визначенні купруму до досліджуваного розчину додають сульфатну кислоту для: а) запобігання виділенню водню на катоді; б)для збільшення кислотності розчину; в) для запобігання утворення нітрит-іонів на катоді; г) жодна з відповідей не вірна е) вірні відповіді б) і в).
6. Які з перерахованих катіонів повинні бути відсутні в розчині при кількісному визначенні купруму електролізом? а) Fe3+; б) Sn4+; в) As3+; г) Ag+, д) всі наведені. Вкажіть причину.
1. Яку напругу слід прикласти до електродів для кількісного відділення арґентуму від купруму при електролізі розчинів 0,1 моль/л нітратів цих металів? 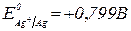 ,
, 
2. Яку напругу слід прикласти до електродів для кількісного відділення купруму від кадмію при електролізі 0,1 моль/л розчинів нітратів цих металів? 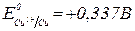 ,
, 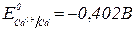
3. Розрахуйте потенціали розкладу 0,1 моль-екв/л розчинів: а) AgNO3; б)Cu(NO3) 2; в) Pb(NO3) 2; г) ZnSO4; д) CdSO4. Відомо, що анод зроблено з гладкої платини.
4. *Кількість Fe3+ у розчині визначали кулонометрично за відновленням до Fe2+ на платиновому електроді. За час електролізу маса катоду послідовно підключеного срібного кулонометра, збільшилася на 0,6140 г. Розрахуйте масу Fe2(SO4)3 у вихідному розчині, якщо вихід за струмом для реакції Fe3+ + 1e ↔ Fe2+ становить 87%.
5. Кількість KMnO4 у розчині з pH 2,0 визначали кулонометрично за відновленням до Mn2+ на платиновому електроді. Відомо, що за час вичерпного електролізу через комірку пройшло 632 Кл електрики, а вихід за струмом становить 100%.
6. Вміст H2S у воді визначали електрогенерованим йодом за реакцією: H2S + I2 = S + 2H+ + 2I-. Для цього до проби води об`ємом 25,0 мл додали 3,0 г КІ та пропустили струм силою 66,5 мА впродовж 7хв 25 с. Розрахуйте концентрацію H2S (мг/л) в пробі.
7. Один з методів кількісного визначення Fe(II) грунтується на його кулонометричному титруванні перманганат-іонами, що утворюються при електролізі підкисленого розчину MnSO4. Розрахуйте скільки часу піде на титрування 10,0 мл досліджуваного розчину з титром 0,0035 г/мл, якщо для генерації титранту використовували джерело постійного струму, силою І=10,00 мкА.
8. Через розчин CuSO4 пропускали струм впродовж 30 хв. При цьому на катоді виділилося 0,25 г купруму. Амперметр показував, що сила струму дорівнювала 0,4 А. Чому дорівнює похибка в його показаннях?
9. Розрахуйте мінімальну напругу, яка необхідна для кількісного виділення: а) аргентуму на срібному катоді з 0,1 моль/л азотнокислого розчину; б) купруму на мідному електроді з 1,0 моль/л азотнокислого розчину; цинку на цинковому електроді з 0,1 моль/л сірчанокислого розчину? Відомо, що анод зроблено з гладкої платини.
|
|
|
|
|
Дата добавления: 2015-05-29; Просмотров: 557; Нарушение авторских прав?; Мы поможем в написании вашей работы!