
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Макроэлементы 2 страница
|
|
|
|
Биологическая активность и токсичность p-элементов. Среди р -элементов в биологических системах наиболее распространены неметаллы водород, углерод, азот, кислород, фосфор, сера и хлор,важные биологические функции выполняют микроэлементы: иод, кремний, бор, селен, фтор, мышьяк и бром.
р -Металлы в большинстве случаев токсичны для организма, что объясняется тем, что, проявляя свойства мягких кислот, их ионы образуют прочные связи с кислород- и серосодержащими группами таких биолигандов, как белки (в т.ч. ферменты), нуклеиновые кислоты и т.д.
Биологическая активность и токсичность d-элементов. d -Блок Периодической системы включает 32 элемента 4–7-го больших периодов, для которых строение внешних электронных оболочек атомов можно выразить общей формулой: (п – 1) dansb,
| где | а = | 0–10, |
| b = | 1; 2. |
Для d -металлов наиболее характерно образование координационных соединений с разнообразными, в т.ч. и биогенными, лигандами, что в основном и определяет их биологическую активность. Наличие d -орбиталей, лишь частично заполненных электронами, позволяет катионам этих металлов взаимодействовать с лигандами – анионами или электродонорными молекулами. Геометрия образующихся комплексов зависит от природы иона металла-комплексообразователя. Комплекс может иметь структуру тетраэдра, плоского квадрата, тригональной бипирамиды или октаэдра. При анализе структуры, физико-химических и биохимических свойств этих комплексов особое внимание обращается на природу связи и на геометрию комплекса. В координационных соединениях ионы d -металлов способны образовывать кроме σ-связей прямые и обратные дативные π-связи. Это обусловливает высокую комплексообразующую способность и непостоянство координационных чисел d -металлов. Как правило, в биокомплексах это четные координационные числа от 4 до 8, реже 10 и 12.
Можно утверждать, что в биосистемах свободных ионов d -металлов практически нет, так как они или гидролизуются, или находятся в составе координационных соединений. Чаще всего d- элементы участвуют в биохимических реакциях в составе комплексов с лигандами – аминокислотами, пептидами, белками, гормонами, нуклеиновыми кислотами и т.д. Наиболее распространенные металлоферменты, такие, как карбоангидраза, ксантинооксидаза, цитохромы и др., представляют собой биокомплексы d -металлов. Простетические группы гемоглобина, трансферрина и других сложных белков также представляют собой хелатные комплексы d -металлов.
Жизненно необходимые металлы Zn, Cu, Fe, Mn, Со, Мо («металлы жизни») входят в состав различных металлоферментов, катализирующих кислотно-основные и окислительно-вос- становительные биохимические реакции.
Многие соединения d -элементов, особенно производные Cd, Hg, V, Ag, Ni и Zn, оказывают на живые организмы токсическое действие, механизмы которого будут рассмотрены на конкретных примерах далее.
Большинство методов определения минеральных веществ (микроэлементов) в пищевых продуктах можно разделить на три типа.
Тип I – наиболее точные и сложные, которые могут использоваться только в исследовательских лабораториях) например, нейтронно-активационный анализ);
Тип II – арбитражные, которые требуют весьма сложного оборудования, но могут быть использованы на производстве (например, ААС)
Тип III – альтернативные (для текущих анализов), которые не требуют сложного оборудования, но по точности не уступают методам II типа (колориметрические, полярографические).
Для анализа минеральных веществ в основном используются физико-химические методы – оптические и электрохимические.
Оптические методы. Фотометрический анализ. Фотометрический анализ (молекулярная абсорбционная спектроскопия) основан на поглощении молекулами вещества излучений в ультрафиолетовой, видимой и инфракрасной областях электромагнитного спектра (медь, железо, хром, никель и др.).
- Фотоэлектроколориметрия – основана на измерении поглощения окрашенными растворами монохроматического излучения в видимой области спектра. Измерение с помощью фотоэлектроколориметров, снабженных узкополосными светофильтрами.
- Спектрофотометрия – измерение поглощения монохроматического излучения в УФ, видимой и ИК областях спектра. Измерения с помощью спектрофотометров, где в качестве монохроматоров – диспергирующие призмы и дифракционные решетки.
Количественный анализ обычно проводят методом градуировочного графика.
Эмиссионный спектральный анализ. Эмиссионный спектральный анализ основан на измерении длины волны, интенсивности и других характеристик света, излучаемого атомами и ионами вещества в газообразном состоянии. Эмиссионный спектральный анализ позволяет определить элементарный состав неорганических и органических веществ.
Интенсивность спектральной линии определяется количеством возбужденных атомов в источнике возбуждения, которое зависит не только от концентрации элемента в пробе, но и от условий возбуждения. При стабильной работе источника (электрическая дуга, искра, пламя) возбуждения связь между интенсивностью спектральной линии и концентрацией – линейна и можно использовать метод градуировочного графика. Методом определяют свыше сорока элементов (щелочные, щелочно-земельные, медь, марганец и др.)
Атомно-абсорбционная спектроскопия. Метод основан на способности свободных атомов элементов в газах пламени поглощать световую энергию при характерных для каждого элемента длинах волн. Практически полностью исключена возможность наложения спектральных линий различных элементов, т.к. их число в спектре значительно меньше, чем в эмиссионной спектроскопии. Уменьшение интенсивности резонансного излучения подчиняется экспоненциальному закону. Аналогичному закону Бугера-Ламберта-Бера. Разработаны методики более чем для 70 элементов. Арбитражный метод для большинства микроэлементов. Иногда необходимо предварительное концентрирование или использование графитовой кюветы, или и то и другое.
Электрохимические методы. Ионометрия. Ионометрия используется для определение ионов K, Na, Ca, Mg, F, I, Cl и т.д. Метод основан на использовании ионселективных электродов, мембрана которых проницаема для определенного типа ионов (отсюда высокая селективность, как правило). Используют либо калибровочный график (Е-рС), либо метод добавок.
Полярография. Переменно-токовую полярографию используют для определения ртути, кадмия, свинца, меди, железа. Метод основан на изучении вольтамперных кривых, полученных при электролизе окисляющегося или восстанавливающегося вещества. Электрод – чаще всего ртутный капельный, иногда – платиновый, графитовый.
Кальций (от лат. calcium – Ca). Кальций составляет (вместе с фосфором) основу костной ткани и зубов, входит в состав ядер клеток, клеточных и тканевых жидкостей, активизирует деятельность ряда важных ферментов, участвует в поддержании ионного равновесия в организме, влияет на процессы, происходящие в нервно-мышечной и сердечно-сосудистой системах, обеспечивает процесс свертывания крови; участвует в передаче нервных импульсов, передаче сигналов через клеточную мембрану, сокращении мышц, деятельности мышцы сердца. Таким образом, кальций выполняет не только пластические функции, но и влияет на многие биохимические и физиологические процессы в организме.
Кальций относится к трудно усваиваемым элементам. Поступающие в организм человека с пищей соединения кальция практически нерастворимы в воде. Щелочная среда тонкого кишечника способствует образованию трудно усваиваемых соединений кальция, и лишь воздействие желчных кислот обеспечивает его всасывание.
Потребность взрослых людей в кальции – около 800 мг, а для детей и подростков – 1000 и более мг в сутки. Больше всего кальция в молоке (120 мг%) и молочных продуктах. При недостаточном потреблении кальция или нарушении его всасывания в организме (при недостатке витамина D) развивается состояние кальциевого дефицита. Наблюдается повышенное выведение его из зубов и костей. У взрослых развивается остеопороз – деминерализация костной ткани, у детей нарушается становление скелета, развивается рахит.
Почти 4/5 всей потребности в кальции удовлетворяется молочными продуктами. Это – лучшие источники кальция (сыры, творог – 100–1000 мг/100 г продукта). Значительно меньше кальция в яйцах, мясе, рыбе, овощах, фруктах, ягодах (20–40 мг%). Следует отметить, что в некоторых растительных продуктах содержатся вещества, уменьшающие всасывание кальция. Например, фитиновые кислоты, содержащиеся в злаковых, и щавелевая кислота в щавеле и шпинате. В результате взаимодействия этих кислот с кальцием образуются нерастворимые фитаты и оксалаты кальция.
Магний (от лат. magnesium – Mg). Магний – жизненно важный элемент, участвующий в формировании костей, регуляции работы нервной ткани, в обмене углеводов и энергетическом обмене, активизирует ряд ферментов, участвует в поддержании нормальной функции нервной системы и мышцы сердца, оказывает сосудорасширяющее действие, повышает двигательную активность кишечника, что способствует выведению шлаков из организма (в том числе и холестерина).
Усвоению магния мешает наличие фитина и избыток жиров и кальция в пище.
Потребность точно не определена. Считают, что доза 200–300 мг/сут предотвращает появление недостаточности (предполагается, что всасывается около 30% магния). Ранее считали, что суточная потребность составляет 400 мг.
При недостатке магния нарушается усвоение пищи, задерживается рост, в стенках сосудов откладывается кальций. У человека недостаток ионов магния, обусловленный характером питания, маловероятен.
Магнием богаты в основном растительные продукты. Большое количество его содержат пшеничные отруби, крупы (40–200 мг%), бобовые, курага, чернослив. Мало магния в молочных продуктах, мясе, рыбе, макаронных изделиях, большинстве овощей и фруктов (20–40 мг%). Почти 1/2 нормы удовлетворяется хлебом и крупяными изделиями. В некоторых важных процессах магний выступает как антагонист кальция, избыток магния снижает усвояемость кальция. Оптимальное соотношение кальция и магния 1:0,7 (0,5).
Определение кальция и магния. Определение кальция и магнияпроводят, как правило, одним и тем же методом. Метод основан на комплексонометрическом определении с помощью трилона Б. Кальций определяют при рН 13, магний – в той же пробе дополнительным титрованием при рН 10.
Для подготовки пробы используется как простое сухое, так и мокрое озоление. Мокрое озоление проводят азотной и хлорной кислотами. Использование серной кислоты не допускается из-за образования нерастворимого осадка сульфата кальция. Золу растворяют в разбавленной соляной кислоте.
Проведение определения.
1.Установление титра трилона Б. Титр устанавливается по эталонному раствору хлорида кальция или хлорида магния. Например, титруют раствор соли магния в присутствии аммиачного буфера и хромогена раствором ЭДТА до перехода окраски из вишневой в синюю.
2.Определение кальция. К исследуемому раствору, который при необходимости разбавляют, добавляют КОН или NaОН до рН 13 и индикатор (эриохром черный, мурексид, хромоген темно-синий). Раствор титруют 3 раза до перехода розовой или малиновой окраски в темно-синюю или фиолетовую, в зависимости от индикатора.
3.Определение магния. Обычно магний определяют в той же колбе, что и кальций. Жидкость подкисляют до рН 11,5–12 разбавленной (1:1) соляной кислотой, добавляют аммиачный буфер (рН должно быть 10), добавляют раствор диэтилдитиокарбамата натрия для связывания тяжелых металлов и титруют раствором трилона до перехода окраски в сине-голубую. Дополнительное количество трилона, пошедшее на титрование, соответствует содержанию магния в пробе. Иногда определяют сумму кальция и магния в отдельной пробе. Щелочью доводят рН до 10, добавляют аммиачный буфер, индикатор, диэтилдитиокарбамата натрия и титруют трилоном Б. Содержание магния определяют по разности между вторым (сумма кальция и магния) и первым (кальций) титрованием.
При наличии необходимого оборудования кальций и магний определяют атомно-абсорбционным методом.
| Дитиокарбаматы – соли дитиокарбаминовых кислот. Соли аммония, щелочных металлов растворимы в воде. Соли Mn, Fe, Co, Ni, Pb, Hg, Zn не растворимы в воде. Дитиокарбамат натрия (купраль) используется в аналитической химии (концентрирование, маскирование, разделение).
|
Объемный метод определения кальция. Объемный метод определения кальцияоснован на осаждении кальция насыщенным раствором (NH4)2C2O4 (щавелевокислого аммония). Отцентрифугированный и отмытый осадок оксалата кальция растворяют в минеральной кислоте. Образовавшуюся при этом щавелевую кислоту титруют раствором перманганата калия.
Ca2+ + C2O42– ® CaC2O4¯
CaC2O4 + 2HCl ® CaCl2 + H2C2O4
2MnO4– + 5C2O42– + 16H+ ® 2Mn2+ + 10CO2 + 8H2O
Для определения малых концентраций используют атомно-абсорбционный анализ (характеристические длины волн для кальция – 422,7, магния – 285,2 нм), эмиссионный, флуоресцентный анализ, чувствительность которых 10–2–10–6 мас.%.
Ионообменная хроматография. Для определения кальция и магния успешно используется ионообменная хроматография. Метод основан на обратимом стехиометрическом обмене ионов, находящихся в растворе, на ионы, входящие в состав ионообменника (катионита, анионита), а также на различной способности разделяемых ионов к ионному обмену с фиксированными ионами сорбента, образующимися в результате диссоциации ионогенных групп сорбента. Разделение ионов регулируют подбором рН элюента. Ионообменная хроматография позволяет определять в одной пробе ионы Са2+, Na+, К+, М g2+, NH4+.
Фосфор (от лат. phosphorus – P). Фосфор – важнейший элемент, входящий в состав белков, нуклеиновых кислот, костной ткани, мышц. Кроме того, соединения фосфора принимают участие во всех процессах жизнедеятельности организма: в обмене энергии (аденозинтрифосфорная кислота и креатинфосфат являются аккумуляторами энергии, при их гидролизе в клетке выделяется большое количество энергии); синтезе и расщеплении веществ в клетках; регуляции обмена веществ. С превращениями соединений фосфора связаны мышечная и умственная деятельность, жизнеобеспечение организма.
В тканях организма и пищевых продуктах фосфор содержится в виде фосфорной кислоты и ее органических соединений. Содержание органических соединений фосфора в крови меняется в широких пределах. Однако количество неорганического фосфора более или менее постоянно.
Потребность для взрослых – 1200 мг/сут. Она возрастает при больших физических и умственных нагрузках, при некоторых заболеваниях.
Большое количество фосфора содержится в продуктах животного происхождения, особенно в печени, икре, а также в зерновых и бобовых. В этих продуктах от 100 до 500 мг% фосфора. Богатым источником фосфора являются крупы (овсяная, перловая), в них до 300–350 мг%. Однако из растительных продуктов соединения фосфора усваиваются хуже, чем при потреблении пищи животного происхождения. Основное количество фосфора человек потребляет с молоком и хлебом. При избытке фосфора может происходить выведение кальция из костей: образуются растворимые соли, которые извлекаются кровью из костной ткани. Оптимальное соотношение фосфора и кальция 1:1,5. Трудно соблюсти это соотношение, т.к. большинство потребляемых продуктов значительно богаче фосфором, чем кальцием.
В зависимости от содержания фосфора в продукте используют две группы методов для его определения – весовые и колориметрические. Весовые методы более точны, лучше воспроизводимы, т.к. состав осадка с хинолином, используемым при осаждении, практически постоянен, однако эти методы весьма длительны. Колориметрические методы менее трудоемки, чем весовые, но требуют для получения хорошей воспроизводимости тщательного соблюдения условий протекания реакций (рН, температуры). Колориметрические методы более чувствительны, чем весовые, и поэтому часто используются при анализе продуктов, содержащих мало фосфора.
Подготовка пробы. Так как некоторые соединения фосфора летучи, для большинства пищевых продуктов рекомендуется мокрое озоление с помощью кислот. Наиболее распространенными способами минерализации являются: окисление продукта азотной и серной кислотами, смесью серной кислоты с перекисью водорода. Допускается сухое озоление, но только в присутствии нитратов, связывающих фосфор. Простое сухое озоление не допускается.
Весовой метод. Принцип метода основан на выделении фосфора в виде осадка с помощью хинолин-молибдатного реактива. Далее осадок взвешивают (гравиметрическое окончание) или количество фосфора определяют титриметрически по количеству щелочи, пошедшей на нейтрализацию фосфорной кислоты (титриметрическое окончание).
Проведение определения. Готовят раствор осадителя, содержащий молибдата натрия, лимонную кислоту и азотную кислоту. Затем при перемешивании сливают этот раствор с раствором хинолина и оставляют на 24 часа. Затем фильтруют, добавляют ацетон и разбавляют водой. К минерализованной пробе добавляют раствор осадителя и кипятят 1 минуту, охлаждают при перемешивании и фильтруют под вакуумом через предварительно прокаленный и взвешенный фильтр. Промывают осадок водой. Фильтр сушат при температуре 260ºС (1 час), охлаждают в эксикаторе и взвешивают. Для определения фосфора массу осадка умножают на 0,014.
| Молибдат аммония в азотнокислой среде образует с фосфатами желтый кристаллический осадок фосформолибдата аммония:
Na3PO4 + 3NH4Cl + 12(NH4)2MoO4 + 24HNO3 ®
® (NH4)3H4[P(Mo2O7)6]¯ + 10H2O + 24 NH4NO3 + 3NaCl
PO43– + 12MoO4– + 3NH4+ + 24H+ = (NH4)3H4[P(Mo2O7)6]¯ + 10H2O
Реакция с молибдатом аммония имеет несколько модификаций, основанных на способности фосфорномолибденовой кислоты образовывать нерастворимые осадки с органическими основаниями различного цвета. Так, при добавлении фосфатов к раствору молибдата дианизидина образуется коричневый осадок фосформолибдатат дианизидина, молибдат хинолина образует фосформолибдат хинолина ярко-желтого цвета. Реакции мешают восстановители.
|
Титриметрический метод. Проведение определения: раствор, полученный после минерализации пробы смесью серной и азотной кислот нейтрализуют аммиаком до появления осадка, добавляют азотную кислоту, насыщенный раствор нитрата аммония и нагревают до 40°С. И при перемешивании приливают раствор молибдата аммония. Смесь перемешивают и оставляют на 1 час, фильтруют так, чтобы осадок остался в стакане. Осадок промывают 1%-ной азотной кислотой, водой до нейтральной среды промывных вод. Фильтр с осадком переносят в колбу, в которой проводилось осаждение, и добавляют туда точно фиксированное количество 0,1 н. раствора гидроокиси натрия для полного растворения осадка, разбавляют водой, добавляют фенолфталеин и избыток щелочи оттитровывают 0,1 н. раствором серной кислоты.
При использовании титриметрического метода определения фосфора возможно также осаждение фосформолибдата 8-гидроксихинолином. Полученный осадок, как и в предыдущем случае, растворяют в избытке щелочи, а избыток щелочи оттитровывают кислотой.
Колориметрические методы. Колориметрические методы более чувствительны, чем весовые, и позволяют анализировать продукты с низким содержанием фосфора. Существует две группы методов.
1.Ранее были широко распространены методы, основанные на образовании в кислой среде синего фосфорно-молибденового комплекса или так называемой «молибденовой сини». Молибденовые сини представляют собой ярко-синие вещества переменного состава, например, Mo8O23·8H2O, Mo4O11·H2O, Mo2O5·H2O. В присутствии фосфора образуется фосфорно-молибденовый комплекс H7{P(Mo2O7)OMo3O6}. Получают их действием восстановителей на растворы молибдатов. Сини поглощают при 620 нм. Восстановление проводят в мягких условиях, чтобы исключить восстановление содержащихся в растворе ионов МоО4– (гидразин, аскорбиновая кислота). Часто используется сложный реагент, содержащий (NH4)2MoO4, сульфат гидразина и серную кислоту в соответствующих концентрациях.
Методы, использовавшиеся для определения фосфора, отличались природой восстановителя: гидразин, пирокатехин, амидол. Однако эти методы оказались недостаточно воспроизводимыми, т.к. состав образующегося комплекса непостоянен. Поэтому в последнее время эти способы стали вытесняться колориметрическим методом, основанным на использовании молибденванадиевого реактива, который характеризуется значительно лучшей воспроизводимостью. Поэтому молибденванадиевый метод рекомендуется как более предпочтительный по сравнению с методами, основанными на образовании «молибденовой сини». Оптимальная кислотность при определении соответствует 0,5 н. При более высокой кислотности образование комплекса замедляется.
2.Метод с использованием молибденванадиевого реактива (метод фосфорнованадиево-молибденовой кислоты).Метод гостирован в Республике Беларусь.
Если к кислому раствору, содержащему анионы фосфат- и ванадат-ионы, прибавить молибдат, то образуется фосфорнованадиево-молибденовая гетерополиксилота (с соотношением P:V:Mo = 1:1:11) желто-оранжевого цвета (e = 20000, lмах = 315 нм). Раствор не должен содержать восстановителей.
Стадии определения: сухая минеральзация, растворение золы в соляной кислоте при нагревании, проведение реакции с молибденванадиевым реактивом, измерение интенсивности желтой окраски при помощи фотоэлектроколориметра или спектрофотометра.
Раствор, полученный после минерализации разбавляют в зависимости от содержания фосфатов, добавляют молибденванадиевый реактив (реактив содержит молибдат аммония, ванадат аммония и азотную кислоту). Через 5 мин измеряют оптическую плотность при 436 нм (кювета 1 см). Расчет производят по калибровочной прямой, содержащей не менее 5 точек. Для этого готовят стандартные растворы по дигидрофосфату калия, выдерживаемые после добавления реактива в течение 30 мин при температуре 20–30ºС. Раствором сравнения служит раствор, приготовленный, как и раствор для измерений, но не содержащий образца (холостой). Реакцию проводят при рН 0,5.
Несмотря на худшую воспроизводимость колориметрического метода по сравнению с весовым, он используется чаще, поскольку его применение позволяет значительно сократить время анализа. Весовой метод используется как арбитражный.
Для определения фосфора могут также использованы методы атомно-абсорбционного, люминисцентного анализа, ЯМР и др.
Натрий (от лат. natrium – Na). Натрий – жизненно важный межклеточный и внутриклеточный элемент (играет важную роль в процессах внутриклеточного и межтканевого обмена веществ). Содержится во всех тканях и биологических жидкостях организма. Участвует в создании необходимой буферности крови, регуляции кровяного давления, водного обмена (ионы натрия способствуют набуханию коллоидов тканей, что задерживает воду в организме), активации пищеварительных ферментов, регуляции нервной и мышечной ткани. Легко всасывается. Содержание Na в организме человека 1,4 г/кг.
Естественное содержание натрия в пищевых продуктах относительно невелико 15–80 мг%. Обычно взрослый человек потребляет 4–6 г, а то и 15 г натрия в день. Основное количество (свыше 80%) организм получает при потреблении продуктов, приготовленных с добавлением поваренной соли. Потребность в натрии минимально составляет 1 г/сут и она возрастает почти в 2 раза при сильном потоотделении в условиях жаркого климата, при сильных физических нагрузках. Растительная пища, особенно картофель, богата калием и усиливает выделение хлористого натрия с мочой, а следовательно, и повышает потребность в нем.
Избыточное потребление натрия с поваренной солью перегружает почки (ухудшается удаление конечных продуктов обмена) и сердце, способствует повышению кровяного давления, недостаток натрия также ведет к нарушениям.
Определение натрия с помощью пламенного фотометра. Определение натрия часто проводится с помощью пламенного фотометра. Поскольку во многих пищевых продуктах содержится много калия, который при некоторых условиях может мешать определению, это должно учитываться при определении. Ошибки незначительны при использовании спектрофотометров, в которых можно точно установить ширину щели (589 нм), и могут быть существенными при использовании фотометров с широкополосными фильтрами. Обычно определения калия и натрия совмещают. Для устранения помех можно добавлять в стандарты и в исследуемый раствор соли лития или цезия (1–2 г/л).
Для подготовки пробы используется как сухое, так и мокрое озоление. Эти методы используются в основном при определении естественного содержания натрия. При сухом озолении рекомендуется смешивать образец с разбавленной серной кислотой и доозолять с азотной кислотой. Зола растворяется в разбавленной соляной кислоте. Мокрое озоление рекомендуется проводить азотной и серной кислотами или азотной, серной и хлорной кислотами. Для пищевых продуктов, в которые добавлялся хлорид натрия, можно применять трехкратную экстракцию теплой водой тонкоизмельченного материала с последующим исследованием экстракта.
Проведение определения.
1. Определение на приборе с широкополосным фильтром. Готовят серию не менее 6 стандартов, которые следует хранить в посуде из полиэтилена. В начале и в конце анализа серии образцов строят калибровочную прямую, которую усредняют. По калибровочному графику находят содержание натрия.
2. Определение на спектрофотометре при 589 нм (наиболее интенсивная резонансная линия). Определение производится сериями из трех образцов, включая стандарт с более низким содержанием натрия, чем у исследуемого образца, стандарт с более высоким содержанием натрия и сам исследуемый образец (метод ограничивающих растворов). Расчет делают по формуле:
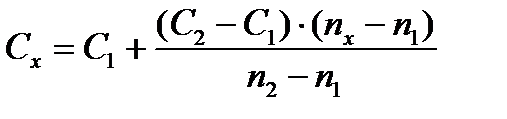
| где | С – | концентрация раствора; |
| n – | показание прибора; | |
| х – | индекс относящийся к анализируемому раствору; | |
| 1 и 2 – | индексы относящиеся к стандартным растворам с более низким и более высоким содержанием натрия, чем в исследуемом образце. |
В продуктах, богатых кальцием, возможны помехи, которые можно устранить только удалением кальция из исследуемого раствора, например с помощью осаждения в виде оксалатов.
В настоящее время для определения натрия все чаще используются атомно-абсорбционные методы. В этом случае помехи от присутствия кальция легко устранимы.
В отсутсвии пламенного фотометра определить натрий можно весовым методом, который основан на осаждении натрия цинкуранилацетатом (в уксуснокислой среде) в виде натрийцинкуранилацетата (NaZn(UO2)3(CH3COO)9·9H2O) зеленовато-желтого цвета.
Zn(UO2)3(CH3COO)8 + CH3COOH + NaCl + H2O ®
® NaZn(UO2)3(CH3COO)9¯ + HCl
Осадок высушивают и пересчитывают на натрий. Метод применим, если соотношение К:Na в продукте не более 25, т.к. при больших концентрациях калий тоже образует с реактивом осадок, что приводит к завышению результатов. Анализу мешают фосфат-ионы, которые удаляют 25%-ным раствором ацетата свинца. Избыток реактива убирают раствором сульфата магния.
При наличии необходимого оборудования натрий может быть определен методами атомно-абсорбционной спектрокопии и ионообменной хроматографии.
Калий (от лат. kalium – K ). Калий – жизненно важный внутриклеточный элемент (90% калия находится внутри клеток), регулирующий кислотно-щелочное равновесие в крови. Он участвует в передаче нервных импульсов, активизирует работу ряда ферментов, регулирует осмотическое давление в клетке. В сыворотке крови содержится 20 мг% калия. Увеличение содержания калия в сыворотке приводит к угнетению автоматизма и сократительной способности миокарда. Уменьшение содержания калия увеличивает опасность аритмии. Калий хорошо всасывается из кишечника, а его избыток быстро удаляется из организма с мочой.
|
|
|
|
|
Дата добавления: 2015-05-29; Просмотров: 1105; Нарушение авторских прав?; Мы поможем в написании вашей работы!