
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Препарати йоду
|
|
|
|
План
1. Лікарські речовини - сполуки галогенів з воднем (кислота хлористоводнева концентрована);
2. Лікарські речовини, що містять солі хлорнуватистої і хлористоводневої кислот (хлорне вапно);
3. Лікарські речовини - галогеніди лужних металів (натрію хлорид, натрію бромід, натрію йодид, калію хлорид, калію бромід, калію йодид);
4. Лікарські речовини, що містять йод (розчин йоду спиртовий 5 % і 10 %, йодинол);
5. Лікарські речовини, що містять марганець (калію перманганат);
6. Лікарські речовини, що містять водню пероксид (розчини водню пероксиду, гідроперіт, магнію пероксид);
7. Лікарські речовини, що містять сірку (натрію тіосульфат, натрію сульфат, сірка для зовнішнього застосування).
Лікарські речовини - сполуки галогенів з воднем. Кислота хлористоводнева концентрована (ДФУ) (Acidum hydrochloridum concentrata) НС1
Властивості. Прозора, безбарвна, що димить рідина. Легко змішується з водою.
(Відносна щільність становить близько 1.18)
Кислота хлористоводнева повинна містити не менше 35.0 % і не більше 39.0 % хлороводню (НС1).
Отримання. Промисловий спосіб: прямий синтез з водню і хлору, які утворюються при електролізі розчину натрію хлориду:
NaCI = Na+ +CI-
При дії електричного струму на катоді і аноді відбуваються такі процеси: 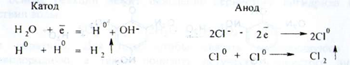
Сумарну схему процесу електролізу можна представити рівнянням:
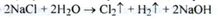
Обидва газу (водень і хлор) спалюють у контактних печах:
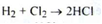
Газоподібний хлороводень (НСI) пропускають через поглинювальні вежі з водою, і в результаті утворюється кислота хлористоводнева з концентрацією 35 - 36% (димо утворююча).
Ідентифікація.
1. Субстанція, розведена водою, повинна мати сильнокислую реакцію (ДФУ).
2. Субстанція дає реакції на СI-(а,в) (ДФУ).
3. Субстанція повинна витримувати вимоги розділу «Кількісне визначення» (ДФУ).
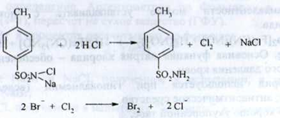
4. При нагріванні препарату з марганцю (IV) оксидом виділяється вільний хлор, який виявляють по запаху:
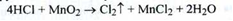
Випробування на чистоту:
Вільний хлор визначають по реакції з калію йодидом у присутності крохмалю:
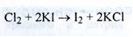
Блакитне забарвлення розчину повинно зникати від додавання 0,2 мл 0,01 М розчину натрію тіосульфату.
Кількісне визначення.
1. Алкаліметрія; індикатор - метиловий червоний; (s = 1) (ДФУ):
HCl + NaOH = NaCl + Н20
2. Кількісний вміст хлороводню можна визначити по щільності.
Застосування. Кислоту хлористоводневу концентровану використовують для приготування кислоти хлористоводневої розведеної, яку застосовують при недостатній кислотності шлункового соку.
Зберігання. У контейнерах зі скла або іншого інертного матеріалу при температурі нижче 30 ° С.
Лікарські речовини, що містять солі хлорнуватистої і соляної кислот. Вапно хлорне
(біле вапно) 

Хлорне вапно є змішаною сіллю хлорнуватисту і хлористоводневої кислот.
отримання: 
Препарат завжди містить у своєму складі гідроксид кальцію.
Властивості. Білий або злегка сіруватий порошок із запахом хлору. Частково розчинний у воді.
Ідентифікація.
1. Розчин речовини 1:10 наносять на червоний лакмус, з'являється синє забарвлення
(рН> 7), яке знебарвлюється внаслідок руйнування індикатора хлором:

2. Від додавання до препарату кислоти хлористоводневої, відбувається його розкладання з виділенням хлору (хлорний розпад):
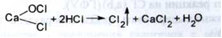
При додаванні розчину калію йодиду, з'являється жовте забарвлення:

3. Іон кальцію визначають з розчином амонію оксалату після попереднього видалення хлору, що досягається кип'ятінням препарату з оцтовою кислотою:
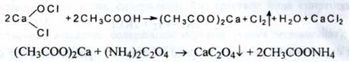
(білий)
Кількісне визначення. Замісна йодометрія; індикатор - крохмаль; (s = 1/ 2):
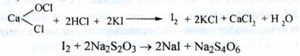
Активного хлору (СІ2) повинно бути не менше 32 %.
Застосування. Дезінфікуючий засіб.
Зберігання. У добре закупореній тарі в сухому, прохолодному, захищеному від світла місці.
Лікарські речовини - галогеніди лужних металів
Натрію хлорид (Natrii chloridum) NaCi (ДФУ)
Калію хлорид (Kalii chloridum) КCI (ДФУ)
Отримання. Натрію хлорид добувають з природної сировини. Видобуток кам'яної солі проводиться закритим способом (рідше - відкритим), із застосуванням підземного вилуговування. Сіль також добувають з води морів і соляних озер випаровуванням. Потім проводять послідовно очищення від домішок. Спочатку осаджують сульфати і фосфати:
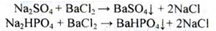
Розчин натрію хлориду відокремлюють від осаду декантацією, нагрівають і обробляють надлишком натрію карбонату для осадження домішок солей Mg,Ca, Ва:
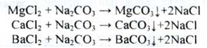
Розчин знову відокремлюють декантацією і видаляють карбонати:
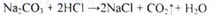
Потім розчин очищають повторно кристалізуючи.
Калію хлорид отримують з мінералів сильвініту (КСI*NaCI) або карналіту (КСI*MgCI2*6H2O). З них виділяють калію хлорид флотацією з подальшим очищенням (аналогічно натрію хлориду).
Властивості. Кристалічні порошки білого кольору або безбарвні кристали. Легко розчиняються у воді, практично нерозчинні у 96 % спирті.
Ідентифікація.
1. Реакції на СГI(а,b) (ДФУ).
2. Реакції на Na+ (а, b, с) (для натрію хлориду) (ДФУ):
а) з розчином калію піроантімоната:
2. Реакції на К + (а, b, с) (для калію хлориду) (ДФУ).
Випробування на чистоту.
Броміди: Визначають спектрофотометрично, після реакції з хлораміном у присутності фенолового червоного і натрію тіосульфату. Оптична щільність отриманого розчину, виміряна при довжині хвилі 590 нм, не повинна перевищувати оптичну щільність еталона, приготованого паралельно і аналогічно випробуваному розчину з використанням розчину калію броміду.
Ферроціаніди:, визначення засноване на реакції утворення берлінської блакиті в результаті взаємодії домішки ферроціанідів з розчином заліза (III) амонію сульфату в розчині кислоти сірчаної. Не повинно з'являтися блакитне забарвлення протягом 10 хв.

У реакційну суміш додають також розчин заліза (II) сульфату для придушення дисоціації комплексу [Fe(CN)6]4- (так як його концентрація дуже мала).
Йодиди. До субстанції додають розчин натрію нітриту в присутності кислоти сірчаної та крохмалю. Через 5 хв отриманий розчин переглядають при денному світлі; не повинно з'являтися синього забарвлення
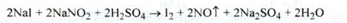
Барій. Визначають по реакції з розчином кислоти сірчаної розведеної. Через 2 год опалесценція отриманого розчину не повинна перевищувати опалесценцію суміші 5 мл розчину S і 7 мл води дистильованої.
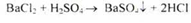
Кількісне визначення.
1. Пряма аргентометрія, точка еквівалентності встановлюється потенціметрично (ДФУ); перерахунок на суху речовину, (s = 1):

2. Зворотній аргентометрія у присутності дибутилфталата (за Фольгарду) (ДФУ); (s=1)

3. Меркуриметрія; індикатор - діфенілкарбазон; (s = 2):
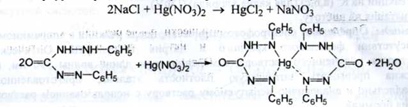
Точку еквівалентності можна встановлювати за допомогою натрію
нітропрусиду:

Застосування. Основна функція натрію хлориду - забезпечення постійного осмотичного тиску крові.
Калій хлорид використовується при гіпокапіеміі (внаслідок прийому діуретиків); антиаритмічний засіб.
Зберігання. У добре закупореній тарі.
Натрію бромід (Natrii bromidum) № Вг (ДФУ)
Калію бромід (Kalii bromidum) КВг (ДФУ)
Отримання. Існують різні способи промислового отримання бромідів. Один з них заснований на використанні заліза (II), (III) броміду, який є відходом деяких хімічних виробництв, або виходить при обробці заліза бромом:
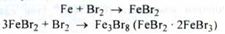
Бромисто - бромнt залізо нагрівають з розчином соди або поташу:
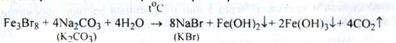
Властивості. Гранульовані порошки білого кольору або дрібні, безбарвні, прозорі або матові кристали. Легко розчиняються у воді, розчиняються в 96 % спирті. Калію бромід легко розчинний у гліцерині.
Ідентифікація.
1. Дають реакції відповідно на К+ і Na+(ДФУ).
2. Реакції на Br - (a, b) (ДФУ).
3. Реакція з сульфатом міді в присутності конц. H2SO4:
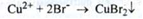
Утворений чорний осад руйнується при додаванні води.
Випробування на чистоту.
Броміди – при відсутності синього або фіолетового забарвлення при додаванні калію йодиду, H4SO4 і крохмалю:
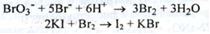
Хлориди (не більше 0,6 %). Розчин субстанції нагрівають з кислотою азотною і розчином водню пероксиду концентрованим (броміди окислюються до брому), а потім визначають домішки хлоридів аргентометрично (за Фольгардом) у присутності дибутилфталата. Паралельно проводять контрольний досвід. На взаємодію з хлоридами має витрачатися не більше 1,7 мл 0,1 М AgNO3.
Йодиди - при додаванні заліза (III) хлориду в присутності метиленхлориду, органічний шар повинен залишатися безбарвним:

Кількісне визначення. Аргентометрія по Фольгарду у присутності дибутилфталата (s = l), перерахунок на суху речовину (ДФУ).
Зміст NaBr у відсотках розраховують за формулою:
А-2.902b
де:
а – вміст NaBr і NaCI, отримане у випробуванні, у відсотках, у перерахунку на NaBr;
b – вміст CI, отримане у випробуванні «Хлориди «, у відсотках.
2,902 – коефіцієнт, що дорівнює відношенню молекулярної маси натрію броміду до атомної масі хлору.
Зміст КВг, у відсотках, обчислюють за формулою:
a-3.357b
де:
а - вміст КВг і KCI, отримане у випробуванні, у відсотках, у перерахунку на КВг;
Ь - зміст CI, отримане у випробуванні " Хлориди ", у відсотках.
3,357 - коефіцієнт, що дорівнює відношенню молекулярної маси калію броміду до атомної масі хлору.
Застосування. Заспокійливі засоби.
Зберігання. У повітронепроникному контейнері.
Натрію йодид (Natrii iodidum) Nal (ДФУ)
Калію йолід (Kalii iodidum) KI (ДФУ)
Отримання. Аналогічно бромід натрію і калію. Залізні стружки обробляють йодом
Властивості. Білі кристалічні порошки або безбарвні кристали. Дуже легко розчиняються у воді, легко розчиняються у гліцерині, розчиняються у 96 % спирті.
Ідентифікація.
1. Дають реакції відповідно на Nа+ і К+ (ДФУ),
2. Реакції на I- (а, b) (ДФУ).
3. Реакція окислення натрію нітритом в кислому середовищі; виділився йод, який забарвлює хлороформний шар у фіолетовий колір:

4. Реакція з заліза (III) хлоридом у присутності хлороформу:

Випробування на чистоту.
Йодити - при відсутності синього забарвлення після додавання крохмалю і кислоти сірчаної розведеної:
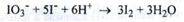
Тіосульфати - після збільшення крохмалю і розчину йоду до розчину субстанції, має зберігатися синє забарвлення:
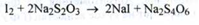
Кількісне визначення.
1. Йодометрія (ДФУ). Субстанцію титрують розчином калію йод в присутності кислоти хлористоводневої до переходу червоного забарвлення в жовтий. Потім додають хлороформ і титрують до знебарвлення суміші, перерахунок на суху речовину (s = 2):
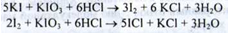
Cумарно:
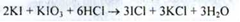
2. Аргентометрія (за Фаянсу); індикатор - еозінат натрію, (s = 1).
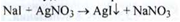
У момент точки еквівалентності осад забарвлюється в рожевий колір внаслідок адсорбції індикатора на осаді.
3. Меркуріметрія без індикатора, (s = 4). У точці еквівалентності з'являється незникаючий червоний осад.
На прикладі калію йодиду:

Надлишкова крапля ртуті нітрату реагує з калію тетрайодомеркуратом і утворюється червоний осад ртуті (II) йодиду:
Застосування. При не достатку йоду в організмі (ендемічний зомб) і деяких запальних захворюваннях.
Зберігання. У захищеному від світла місці.
Йод (Iodum) I2 (ДФУ)
Джерелом отримання йоду служать бурові води і морські водорості (0,5 %).
Розробив процес отримання йоду з нафтових бурових вод професор O.Ю.Магідсон. Процес складається з декількох стадій:
1. Очищення бурових вод від домішок нафти і нафтенових кислот.
2. Окислення йодит - іонів до вільного йоду натрію нітритом у присутності сірчаної кислоти:
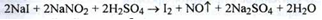
3. Йод, який виділився адсорбують активованим вугіллям.
4. Процес десорбції йоду натрієм гідроксидом:

5. Повторне окислення йодидів до вільного йоду активним хлором:

6. Очищення йоду шляхом сублімації.
Властивості. Тендітні пластинки або дрібні кристали сірувато - фіолетового кольору з металевим блиском. Дуже мало розчинний у воді, розчинний у 96 % спирті, мало розчинний у гліцерині, легко розчинний у концентрованих розчинах йодидів.
Повільно вивітрюється при кімнатній температурі.
Ідентифікація.
1. При нагріванні субстанції в сухий пробірці, йод переганяється, утворюючи фіолетові пари та блакитно - чорний сублімат (ДФУ).
2. Насичений розчин субстанції забарвлюється в синій колір від додавання розчину крохмалю. Забарвлення розчину зникає при нагріванні і знову з'являється при охолодженні (ДФУ).
Випробування на чистоту.
Броміди та хлориди - визначають по реакції з срібла нітратом у присутності розчину аміаку:
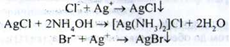
Суміш фільтрують, до розчину додають кислоту азотну. Через 1 хв опалесценція випробуваного розчину має бути не більше за інтенсивністю, ніж опалесценция стандартного розчину, приготованого паралельно змішуванням води, 0,01 М розчину кислоти хлористоводневої, кислоти азотної розведеної і розчину срібла нітрату.
Кількісне визначення.
Розчин субстанції в розчині калію йодиду титрують натрію тіосульфатом у присутності кислоти оцтової розведеної (індикатор - крохмаль) (s = 1/2) (ДФУ).
Оскільки процес протікає в присутності калію йодиду, йод спочатку утворює комплексне з'єднання, яке взаємодіє з натрієм тіосульфатом:
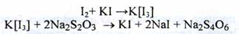
Спрощене написання цієї реакції:

Застосування. Антисептичний засіб.
Зберігання. У контейнері з притертою пробкою.
Розчин йоду спиртовий 5 %
(Solution Iodi spirituosa 5 %) (проект монографії)
Склад: йод - 5,0 г;
калію йодиду - 2,0 г;
спирту (96%) - 41,0 г
води очищеної до 100 г
(Вміст йоду (I) не менше 47,5 мг / мл і не більше 52,5 мг/мл, КI від 19,2 мг/мл до 21 мг/мл)
Властивості. Прозора рідина червоно -коричневого кольору.
Ідентифікація.
1. При додаванні до препарату розчину крохмалю утворюється синьо - фіолетове забарвлення.
2. До препарату додають порціями хлороформ до знебарвлення (екстрагують йод), і у водному шарі проводять реакцію на калій з розчином кислоти винної.
3. У водному витяганні (див. реакцію 2) проводять реакцію (b) на йодиди.
4. Реакція утворення йодоформу:
 Жовтий осад з характерним запахом
Жовтий осад з характерним запахом
Кількісне визначення. Вміст йоду визначають титруванням натрію тиосульфатом до знебарвлення розчину; (s = 1/ 2):
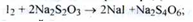
Вміст калію йодиду визначають за методом Фаянсу в відтитрували розчині (індикатор - еозінат натрію) (s = 1):
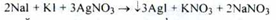
Вміст калію йодиду розраховують за формулою:
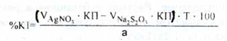
а - об'єм препарату, взятий для аналізу;
Застосування. Антисептичний засіб.
Зберігання: у склянках жовтогарячого скла, у захищеному від світла місця.
Розчин йоду спиртовий 10%
(Solutio Iodi spirituosa 10%)
Склад: йоду 100г
спирт 96% - до 1л
Ідентифікація.
Аналогічно розчину йоду 5 % (див. реакцію 1).
Домішки йодистоводородной кислоти, яка може утворюватися при зберіганні, визначається алкаліметріческім титруванням:

Кількісне визначення.
Титрування нашаруванням, з додаванням розчину калію йодиду, натрію тіосульфатом до знебарвлення розчину:
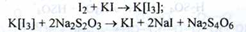
Йода повинно бути 9,5 - 10,5 %. Термін зберігання 1 місяць.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 3176; Нарушение авторских прав?; Мы поможем в написании вашей работы!