
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамика химических процессов
|
|
|
|
I. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
Химическая термодинамика изучает энергетические (в частности тепловые) эффекты, сопровождающие химические процессы, а также направление самопроизвольного протекания реакции в заданных параметрах состояния системы (T, р,V и др.).
При расчетах рассматривают химическую термодинамическуюсистему (систему) – часть пространства, содержащая одно или несколько веществ, реально или мысленно отделенных от окружающей (внешней) среды. Термодинамические свойства системы выражают с помощью характеристических функций: внутренней энергии U, энтальпии H,энтропии S, энергии Гиббса G.
Каждая система при постоянных физических условиях (температура, давление) обладает определенным запасом энергии, называемым внутренней энергией системы /U/. Она представляет энергию движения и местоположения молекул, атомов, ядер и электронов, а также энергию, обусловленную силами притяжения и отталкивания между ними. Однако внутренняя энергия не включает кинетическую энергию движения системы в целом и потенциальную энергию положения системы в пространстве.
Абсолютное значение внутренней энергии определить невозможно. Для химии, однако, важно не абсолютное значение, а изменение внутренней энергии
ΔU = UК – UН,
где UК – внутренняя энергия конечного состояния,
UН – внутренняя энергия начального состояния.
Единицей измерения внутренней энергии является джоуль /Дж/.
Изменение внутренней энергии можно измерить с помощью теплоты и работы, так как система может обмениваться с окружающей средой веществом и энергией.
Теплота (Q) является мерой энергии, переданной от одного тела к другому за счет разницы температуры этих тел. В химической термодинамике считают положительной теплоту, подводимую к системе.
Работа (А) является мерой энергии, переданной от одного тела к другому за счет перемещения масс под действием каких-либо сил. Положительной считается работа, совершаемая против внешних сил.
Взаимосвязь изменения внутренней энергии /ΔU/, теплоты /Q / и работы /А/ выражается первым законом термодинамики: «Теплота, подведенная к системе, расходуется на приращение внутренней энергии системы и на работу совершаемую системой над окружающей средой».
Q = ΔU + A.
Так как теплоту и работу можно измерить, то можно рассчитать изменение внутренней энергии.
ΔU = Q − A
При постоянном давлении (это большинство химических процессов) работа совершается по изменению объема системы, т.е. работа расширения:
А = р ·ΔV,
где р – давление системы,
ΔV – изменение объема системы.
Из первого закона термодинамики в этом случае следует, что
Qр = ΔU + р ∙ΔV.
Подставим значения ΔU = Uк − Uн и ΔV = Vк − Vн,
тогда Qр = (Uк – Uн) + р ·(Vк – Vн).
Окончательно Qр = (Uк + р ·Vк) – (Uн + p ·Vн).
Функцию (U + р ·V) называют энтальпией и обозначают «Н».
Энтальпия – термодинамическая функция, характеризующая состояние системы (как и внутренняя энергия). Абсолютное значение энтальпии системы определить невозможно. Поэтому рассчитывают изменение энтальпии «ΔН» которое относят к 1 молю и размерность термодинамической функции энтальпия выражают в кДж/моль.
Для сравнения энтальпии различных систем значения этих величин приводят к одинаковым (стандартным) условиям. В качестве стандартных условий в химической термодинамике выбраны: температура 298°К /25°С/ и давление 101, З кПа /1 атм/.
Величины ΔU и ΔН в этих условиях называют стандартными и обозначают
ΔU°298 и ΔН°298
Из первого закона термодинамики следует, что для процессов, идущих при постоянном давлении «Теплота, подведенная к системе расходуется на приращение энтальпии системы”.
Qр = Нк – Нн = ΔН,
где Н К – энтальпия системы конечного состояния,
Н Н - энтальпия системы начального состояния,
Каждая химическая реакция сопровождается выделением или поглощением тепла. Количество выделенной или поглощенной теплоты называют тепловым эффектом. Тепловой эффект реакции припостоянном давлении /Qp / называют энтальпией реакции /ΔН/.
Химические реакции, сопровождающиеся выделением тепла системой в окружающую среду, называются экзотермическими. Для экзотермических реакций энтальпия реакции имеет отрицательное значение, т.к. энтальпия образования продуктов меньше, чем энтальпия образования исходных веществ (ΔΗ<0). Результатом экзотермической реакции является повышение температуры системы.
Химические реакции, сопровождающиеся поглощением тепла системой из окружающей среды, называются эндотермическими. Для эндотермических реакций энтальпия реакции имеет положительное значение, т.к. энтальпия образования продуктов больше, чем энтальпия образования исходных веществ (ΔΗ > 0). Результатом эндотермической реакции является понижение температуры системы.
В термодинамике химическая реакция записывается термохимическим уравнением, в котором указываются исходные вещества и продукты реакции, их агрегатные состояния, а также значение энтальпии реакции. Агрегатные состояния обозначают следующим образом:
/тв/ или /к/ - твердое,
/ж/ - жидкое,
/г/ - газообразное.
Например, термохимическое уравнение образования оксида углерода (II) из углерода и оксида углерода (IV) запишется
С(тв) + CО2(г) = 2СО(г) ΔH°298 = +173 кДж.
По I закону термодинамики можно рассчитать тепловой эффект реакции протекающей при постоянном давлении. Для этого необходимо рассчитать энтальпию системы начального состояния – Нн (энтальпию образования исходных веществ) и энтальпию системы конечного состояния – Нк (энтальпию образования продуктов).
Энтальпия реакции рассчитывается по следствию закона термохимии. Закон Гесса: сумма энтальпии двух и более промежуточных реакций при переходе от исходного состояния системы к конечному состоянию равна энтальпии реакции, которая непосредственно ведет от исходного состояния к конечному состоянию.
Например, процесс образования оксида железа (III) из железа и кислорода
2Fe (тв) + 3/2O2 (г) = Fe2O3(тв) ΔH°298 = − 822,71 кДж. (I)
Эта реакция может протекать в две стадии:
2Fe (тв) + O2 (г) = 2FeO(тв) ΔH°298 = − 532,98 кДж (II)
2FeO(тв) +1/2O2 (г) = Fe2O3(тв) ΔH°298 = − 289,73 кДж (III)
 ΔH°298 = − 822,71 кДж
ΔH°298 = − 822,71 кДж
Сложив уравнения II и III, получаем уравнение I.
Следствие закона Гесса: «энтальпия реакции зависиттолько от вида и состояния исходных веществ и продуктов, но не зависит от промежуточных состояний и пути перехода от реагентов к продуктам».
По следствию закона Гесса: «энтальпия реакции представляет собой разность между суммой энтальпии образования продуктов реакции и суммой энтальпии образования исходных веществ с учетом стехиометрических количеств веществ (n)», что можно записать
ΔΗреакции = Σ (n ∙ΔΗ)прод. – Σ (n ∙ΔΗ)исх.
Как уже отмечалось, абсолютное значение термодинамической функции энтальпия определить пока невозможно.
Энтальпия образования простых веществ принимается равной нулю, если их агрегатные состояния и аллотропные модификации при стандартных условиях устойчивы.
Например, ΔΗ°298 графита/тв/ = 0,0 кДж/моль
ΔΗ°298 алмаза/тв/ = 1,9 кДж/моль,
т.е. графит является более устойчивой модификацией углерода, чем алмаз.
Энтальпия образования сложного вещества принимается равной энтальпии реакции (тепловому эффекту) образования одного моля этого вещества из простых веществ. Единицей измерения энтальпии образования веществ является кДж/моль.
Например, из термохимического уравнения реакции образования водяного пара из водорода и кислорода
2H2(г) +O2(г) = 2H2О(г) ΔΗ°298 = - 484кДж
следует, что энтальпия образования воды в газообразном состоянии
ΔΗ°298 (н2о) = (-484) кДж / 2 моль = (-242) кДж/моль.
Энтальпия реакции зависит от агрегатного состояния исходных веществ и продуктов реакции.
Например, H2(г) + 1/2O2(г) = H2O(ж) ∆ Hо298 = -285 кДж/моль,
H2(г) + 1/2O2(г) = H2O(г) ∆Hо298 = -242 кДж/моль.
 Отсюда можно найти энтальпию /тепловой эффект/ фазового перехода вещества:
Отсюда можно найти энтальпию /тепловой эффект/ фазового перехода вещества:
H2O(ж) парообразование H2O(г)
∆Hо298 (парообразование) = (-242) – (-285) = 43; ∆Hо298 = 43 кДж/моль.
Пример 1. Рассчитать тепловой эффект реакции (энтальпию реакции) в стандартных условиях. Указать эндотермической или экзотермической является данная реакция.
4NН3(г) + 5О2(г) = 4NО(г) + 6Н2О(г)
Решение. Из термохимического уравнения следует, что в реакции участвуют и образуются вещества в количестве:
4NН3(г)+ 5О2(г)= 4NО(г)+ 6Н2О(г)
число молей: 4 5 4 6
Из таблицы термодинамических функций (см. табл. 2) находим, что энтальпия образования веществ в стандартных условиях (ΔΗ°298) равна
ΔΗ°298 кДж/моль: -46 0 +91 -242
Используя уравнение расчета энтальпии реакции
ΔΗ°реакции =[4· ΔΗ°NO + 6·ΔΗ°н2о] – [4 · ΔΗ°Nн3 + 5 · ΔΗ°о2], находим
ΔΗ°298 реакции = [4 · (+91) + 6 · (-242)] – [4 · (-46) + 5· 0] = –904 кДж/моль.
Ответ. Тепловой эффект реакции равен –904 кДж/моль. Данная реакция является экзотермической, так как сопровождается выделением тепла.
Пример 2. Реакция горения этана (C2H6) выражается термохимическим уравнением
C2H6(г) + 31/2O2(г) =2CO2(г) + 3H2O(ж) ΔΗ°реакции = –1559,9 кДж
Рассчитать энтальпию образования этана в стандартных условиях.
Решение. Из термохимического уравнения следует, что в реакции участвуют и образуются вещества в количестве:
C2H6(г) + 31/2O2(г) =2CO2(г) + 3H2O(ж)
число молей: 1 3,5 2 3
Из таблицы термодинамических функций (см. табл. 2) находим, что энтальпия образования веществ в стандартных условиях (ΔΗ°298) равна
ΔΗ°298 кДж/моль: неизвестна 0 -393,8 -286,4
Используя уравнение расчета энтальпии реакции
ΔΗ°298 реакции = [2 · ΔΗ°со2 + 3 · ΔΗ°н2о] – [1 · ΔΗ°с2н6 + 3,5 · ΔΗ°о2], находим, что энтальпия образования этана равна
ΔΗ°298 (С2Н6) = [2 · ΔΗ°со2 + 3 · ΔΗ°н2о] – [ΔΗ° реакции + 3,5 · ΔΗ°о2],
ΔΗ°(С2Н6)=[2·(–393,8) + 3 · (–286,4)] – [–1559,9 + 3,5 · 0] = –86,9 кДж/моль.
Ответ. Энтальпия образования этана в стандартных условиях равна –86,9кДж/моль
Пример 3. При взаимодействии 1,9 г алюминия с кислородом выделилось 59 кДж. Рассчитать энтальпию образования оксида алюминия.
Решение. Реакция горения алюминия в кислороде является экзотермической реакцией и выражается уравнением
4Al(тв) +3O2(г) =2Al2O3(тв)
Энтальпия образования сложного вещества принимается равной энтальпии реакции образования одного моля этого вещества из простых веществ.
Термохимическое уравнение запишется
2Al(тв) +11/2O2(г) =Al2O3(тв) ∆H < 0
Как видно из термохимического уравнения для образования одного моля оксида алюминия необходимо израсходовать 2 моля алюминия. Два грамм-моля алюминия имеют массу 54 г. (см. Периодическую систему Д.И.Менделеева).
Составим соотношение:
при взаимодействии 1,9 г алюминия выделилось (ΔΗ реакции) 59 кДж.
 при соединении 54 г алюминия ΔΗ реакции равна X кДж.
при соединении 54 г алюминия ΔΗ реакции равна X кДж.
X (тепловой эффект реакции) = 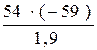 = –1676,8 кДж
= –1676,8 кДж
Ответ. Энтальпия образования оксида алюминия равна –1676,8 кДж/моль, т.к. это тепловой эффект образования одного моля этого вещества из простых веществ.
ЗАДАНИЕ
1.Написать термохимическое уравнение. Рассчитать тепловой эффект реакции сгорания 448л метана при стандартных условиях.
2.Определить энтальпию реакции при стандартных условиях. Указать эндо- или экзотермическая реакция.
CaCO3(TB) = CaO(TB) + CO2(г)
3.Определить энтальпию образования карбоната натрия при стандартных условиях, если тепловой эффект реакции равен 805,7 кДж.
Na2CO3(TB) + 2C(TB) = 2Na(TB) + 3CO(г)
4.Процесс гашения извести водой выражается уравнением
CaO(ТВ) + H2O(ж) = Ca(OH)2(TB).
Рассчитать тепловой эффект этой реакции при стандартных условиях.
5.Рассчитать количество тепла выделяющегося при сгорании 896 л ацетилена (С2Н2) при нормальных условиях:
2С2Н2(г) + 5О2(г) = 4 СО2(г) + 2Н2О(г)
6.Определить количество тепла необходимого для восстановления 5 молей оксида железа (III) при стандартных условиях
Fe2O3(TB) + 3CO(г) = 2 Fe(TB) + 3CO2(г)
7.При соединении 2,1 г железа с серой выделилось 3,77 кДж. Рассчитать энтальпию образования сульфида железа (II).
8.Рассчитать тепловой эффект при сгорании 2240 л бутана при нормальных условиях
2C4H10(г) + 13O2(г) = 8CO2(г) + 10H2O(г)
9.Определить энтальпию реакции при стандартных условиях
Fe2O3(TB) + 3C(графит) = 2Fe(TB) + 3CO(г)
10.Определить энтальпию образования этилена, если тепловой эффект реакции равен -1323 кДж
C2H4(г) + 3О2(г) = 2СО(г) + 2Н2О(г)
11.Процесс восстановления оксида железа (III) водородом выражается уравнением
Fe2O3(TB) + 3H2(г) = 2Fe(TB) + 3H2O(г)
Рассчитать тепловой эффект этой реакции при стандартных условиях.
12.Рассчитать тепловой эффект процесса сгорания 224 л водорода при нормальных условиях
2H2(г) + O2(г) = 2H2O(г).
13. При образовании 1000 мл оксида углерода (IV) из углерода и кислорода выделилось 15,8 кДж. Рассчитать энтальпию образования оксида углерода (IV).
14.Определить энтальпию образования карбоната магния, если тепловой эффект реакции равен -118 кДж.
MgO(TB) + CO2(г) = MgCO3(TB)
15.Написать термохимическое уравнение процесса сгорания пропана (C3H8) в кислороде. Рассчитать тепловой эффект реакции сгорания 112л пропана при стандартных условиях.
16.Рассчитать тепловой эффект реакции при стандартных условиях
СО(г) + 3H2(г) = CH4(г)+ +H2O(г)
17.Рассчитать энтальпию образования жидкого бензола, если тепловой эффект реакции сгорания равен -3136кДж.
2С6H6(Ж) +15O2(Г) = 12СO2(Г) +6H2O(Г)
18.Определить энтальпию образования фосфата кальция, если тепловой эффект реакции равен -739кДж
3CaO(TB) + P2O5(TB) = Ca3(PO4)2(TB).
19.Рассчитать энтальпию конденсации 224 л водяного пара.
20.При образовании 1120мл (при стандартных условиях) оксида серы(IV) из простых веществ выделилось 14,8 кДж. Рассчитать энтальпию образования оксида серы (IV).
При выяснении природы самопроизвольного протекания процессов /без воздействия извне/ было установлено, что самопроизвольные реакции сопровождаются экзотермическим эффектом (ΔΗ < 0), и чем он больше, тем выше химическое сродство реагентов друг к другу. Однако связь между снижением энтальпии системы / энтальпийный фактор/ и ее самопроизвольностью является недостаточным фактором.
Другим фактором определения самопроизвольности протекания химических процессов является термодинамическая функция, называемая энтропией системы (S).
Энтропия является мерой неупорядоченности состояния системы. Чем меньше упорядоченность системы, тем выше энтропия системы. Энтропия является абсолютной величиной для каждого состояния вещества (знак Δ перед обозначением S не ставится). Единицей измерения энтропии является Дж/моль·°К. Энтропия является термодинамической функцией параметров состояния системы. Поэтому в справочных таблицах (см. табл. 2) приводятся значения энтропии простых и сложных веществ в стандартных условиях (S°298).
В ходе химической реакции энтропия системы изменяется. Это изменение называется энтропией реакции.
Энтропию реакции рассчитывают по следствию закона Гесса:
ΔSреакции = Σ (n · S)прод. – Σ (n · S)исх.
Пример 4. Рассчитать энтропию реакции при стандартных условиях. Указать изменение упорядоченности системы для реакции
N2(г) + О2(г) = 2NО(г)
Решение. Из термохимического уравнения следует, что в реакции участвуют и образуются вещества в количестве
N2(г) + О2(г) = 2NО(г)
число молей 1 1 2
Из таблицы термодинамических функций (см. табл. 2) находим, что энтропия веществ в стандартных условиях равна
S°298 Дж/моль · °К. 192 205 211
Используя, уравнение расчета энтропии реакции находим,
ΔS°реакции = 2 · (211) - [1· (192) + 1· (205)] = 25 Дж/моль · °К.
Ответ. Энтропия реакции при стандартных условиях больше нуля, т.е. происходит уменьшение упорядоченности системы.
Все процессы, которые протекают с уменьшением порядка в расположении частиц системы (растворение кристаллов, плавление и др.), сопровождаются увеличением энтропии /ΔS>0/. И, наоборот, процессы кристаллизации, конденсации сопровождаются уменьшением энтропии /ΔS < 0/.
Согласно второму закону термодинамики «в замкнутой /изолированной/ системе самопроизвольно идут процессы, приводящие к росту энтропии системы /ΔS ≥ 0 /».
Для процессов, протекающих при постоянной температуре ипостоянном давлении, движущая сила химического процесса складывается из двух сил: стремление системы перейти в состояние с уменьшением энтальпии (ΔH<0) /энтальпийный фактор/, и стремлением системы перейти в состояние с увеличением энтропии (ΔS>0) /энтропийный фактор/.
Наиболее устойчивому состоянию системы (равновесное состояние) соответствует равенство энтальпийнного и энтропийнного факторов:
ΔΗ = Т·ΔS.
Термодинамическая функция, связывающая энтальпию и энтропию реакции, называется энергией Гиббса (ΔG). Эта функция показывает, насколько система в данном состоянии отклонилась от равновесного состояния. Абсолютное значение энергии Гиббса системы определить невозможно и поэтому рассчитывают изменение энергии Гиббса /ΔG/.
ΔG = ΔН − Т · ΔS.
Единицей измерения энергии Гиббса является кДж/моль.
Значение энергии Гиббса является критерием самопроизвольности протекания химических реакций в прямом или обратном направлении:
при ΔG < 0 /реально меньше –2/ реакция идет самопроизвольно в прямом направлении;
при ΔG = 0 /реально от 0 до –2/ реакция находится в равновесии;
при ΔG > 0 реакция самопроизвольно не идет в прямом направлении, но возможна обратная реакция.
Энергия Гиббса является функцией параметров состояния системы. Поэтому в справочных таблицах (см. табл. 2) приводятся значения энергии Гиббса образования веществ в стандартных условиях (ΔG°298).
Энергия Гиббса образования простых веществ принимается равной нулю, если их агрегатные состояния и модификации при стандартных условиях устойчивы.
Энергия Гиббса образования сложного вещества равна изменению энергии Гиббса системы при образовании 1 моля сложного вещества из простых веществ, устойчивых при стандартных условиях.
Энергия Гиббса реакции может быть рассчитана по следствию закона Гесса:
ΔGреакции = Σ (n · ΔG)прод. – Σ (n · ΔG)исх.
Однако энергия Гиббса химической реакции рассчитанная при стандартных условиях не может быть критерием определения направления протекания реакции в условиях, отличающихся от стандартных.
Для расчета энергии Гиббса реакции протекающей при температуре, отличной от стандартной, должны быть известны стандартная энтальпия реакции, стандартная энтропия реакции, а также температура.
∆G0T = ∆H0298 - T · ∆S0298.
Пример 5. Рассчитать энергию Гиббса реакции в стандартных условиях. Определить какая реакция будет протекать самопроизвольно в системе, прямая или обратная
СО2(г) + С(графит) = 2СО(г)
Решение. Из термохимического уравнения следует, что в реакции участвуют и образуются вещества в количестве:
СО2(г) + С(графит) = 2СО(г)
Число молей 1 1 2
Из таблицы термодинамических функций (см. табл. 2) находим, что энергия Гиббса образования веществ в стандартных условиях равна
ΔG°298 кДж/моль -394 0 -137
Используя уравнение расчета энтальпии реакции
ΔG°298 реакции = [2· ΔG°CO] – [1 · ΔG°CO2 + 1 · ΔG°графит],
находим
ΔG°298 реакции = [2 · (–137)] – [1· (–394) + 1· (0)] = +120 кДж/моль.
Ответ. Энергия Гиббса реакции в стандартных условиях больше нуля. Это указывает, что данная реакция самопроизвольно в прямом направлении не идет.
Пример 6. Установить, в какую сторону сдвинуто равновесие для реакции при 4000К и 1000°К
MgCO3(к) <=> MgO (к) + СO2(г)
Решение. Из термохимического уравнения следует, что в реакции участвуют и образуются вещества в количестве:
MgCO3(к) <=> MgO (к) + СO2(г)
Число молей 1 1 2
Из таблицы термодинамических функций (см. табл. 2) находим, что энтальпия образования веществ и энтропия веществ в стандартных условиях равна
∆H0298 кДж/моль –1113 –602 –349
S0298 Дж/моль0К 66 27 214
Используя уравнение расчета энтальпии реакции (см. пример 2) и энтропии реакции (см. пример 4) находим, что
ΔΗ°298 реакции = +117 кДж/моль,
ΔS°298 реакции = + 0,175 кДж /моль°∙К.
Из выражения ∆G0400 = ∆H0298 – 400 · ∆S0298 следует:
а) при 400°К ΔG°400 = +117 – 400 · 0,175 = +47,0 кДж/моль, т.е. реакция в прямом направлении невозможна;
б) при 1000°К ΔG°1000 = +117 – 1000 · 0,175 = -58,0 кДж/моль, т.е. реакция в прямом направлении возможна.
ЗАДАНИЕ
21.Указать возможность самопроизвольного протекания процесса при стандартных условиях
CaCO3 (TB) = CaO (ТВ) + CO2(г).
22.Определить какая реакция будет протекать при стандартных условиях в системе, прямая или обратная
Fe2O3(TB) +3H2(Г) = 2Fe(TB) + 3H2O(Г)
23.Рассчитать, при какой температуре возможна прямая реакция
Fe2O3(TB) + 3CO(Г) =2Fe(TB) +3CO2(Г).
24.Определить возможность самопроизвольного протекания прямой реакции при температуре 250С.
CH4(г) + 2O2(Г) = CO2(Г) + 2H2O(Г)
25.Определить какая реакция будет протекать при стандартных условиях в системе, прямая или обратная
СH4(Г) + 3СO2(Г) = 4СO(Г) +2H2O(Г).
26.Рассчитать температуру, при которой возможно самопроизвольное протекание реакции
2H2O(Ж) = 2H2(Г) + O2(Г).
27.Определить возможность самопроизвольного протекания реакции при стандартных условиях
4Al(TB) +3CO2(Г) = 2Al2O3(TB) + 3C(ГРАФИТ).
28.В каком направлении самопроизвольно будет протекать реакция в стандартных условиях.
H2(Г) + CO2(Г) = CO(Г) + H2O(Ж)
29.Рассчитать, при какой температуре возможна прямая реакция
CaO(TB) +CO2(Г) = CaCO3(TB).
30.Рассчитать при стандартных условиях энергию Гиббса реакции. Указать возможность самопроизвольного протекания реакции
H2S(г) + 2O2(г) = H2O(г) + SO3(г).
31.Определить какая реакция будет протекать при стандартных условиях в системе, прямая или обратная
2CO(г) + O2(Г) = 2CO2(Г).
32.Рассчитать, при какой температуре возможна прямая реакция
CO(Г) +3H2(Г) = СН4(г) + Н2О(Г).
33.Определить возможность самопроизвольного протекания прямой реакции при стандартных условиях
3Fe(TB) + 4H2O(Г) = Fe3O4(TB) + 4H2(Г).
34. Определить какая реакция будет протекать при стандартных условиях в системе, прямая или обратная
MgO(TB) + CO2(Г) = MgCO3(TB)
35.Рассчитать, при какой температуре возможна прямая реакция
Al2O3(TB) + 3H2(Г) = 2Al(TB) + 3H2O(Г).
36.Рассчитать энергию Гиббса при стандартных условиях для реакции. Возможна ли прямая реакция в этих условиях.
Na2CO3(TB) + 2C(TB) = 2Na(TB) + 3СO(Г).
37.Рассчитать, при какой температуре возможна прямая реакция SO2(Г) + O2(Г) = SO3(Г).
38. Определить какая реакция будет протекать при стандартных условиях в системе, прямая или обратная
CaO(TB) + H2O(ж) = Ca(OH)2(TB).
39. Рассчитать энергию Гиббса при стандартных условиях для реакции. Возможна ли прямая реакция в этих условиях.
Na2CO3(TB) + Ca(TB) = 2Na(TB) + CaСO3(тв).
40.Указать возможность самопроизвольного протекания процесса при стандартных условиях
H2S(г) + 2O2 (г) = SO3 (г) + H2O(г).
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 2536; Нарушение авторских прав?; Мы поможем в написании вашей работы!