
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронная оболочка атома
|
|
|
|
Химические свойства элемента определяются строением электронной оболочки атома. При рассмотрении строения электронной оболочки атома необходимо учитывать, что из-за корпускулярно-волновой природы электрона существует неопределённость в установлении его места пребывания. Эрвин Шредингер предложил волновое уравнение для описания состояния электрона в атоме:
▼2 ψ + 8π2m/h · (E – U) ·ψ = 0.
В уравнение Шредингера входит волновая функция Ψ. Квадрат её модуля / ψ2/ является мерой вероятности нахождения электрона в некотором объеме на определенном расстоянии от ядра. Решение этого уравнения даёт плотность вероятности нахождения электрона в данной области пространства. Область пространства вокруг ядра, для которой вероятность пребывания электрона равна 95%, называется атомнойорбиталью. Электрон не вращается по орбите, а занимает трёхмерную область в пространстве вокруг ядра – орбиталь. Налагаемые на функцию Ψ ограничения приводят к тому, что решения волнового уравнения Шредингера содержат целочисленные значения, называемые квантовыми числами (n, L, m, S).
Квантовые числа характеризуют состояние электрона в атоме (орбиталь электрона).
n – главное квантовое число. Определяет энергетический уровень, на котором находится электрон (орбиталь электрона). Определяет энергию электрона на уровне и размер орбитали. Может принимать значения
n = 1,2,3,4,5,6,7…∞.
В зависимости от значения главного квантового числа электрон может находится на 1, 2, 3 и т.д. энергетическом уровне. Чем больше значение главного квантового числа, тем больше энергия электрона и больше размер орбитали.
L - орбитальное квантовое число. Определяет энергетический подуровень, на котором находится электрон (орбиталь электрона). Определяет энергию электрона на подуровне, а также форму орбитали. Может принимать целочисленные значения
L = от 0 до (n-1).
Например. Четвертый энергетический уровень (n=4) в электронной оболочке содержит четыре подуровня, определяемые значениями орбитального квантового числа L = 0,1,2,3.
Подуровни обозначают латинскими буквами, чтобы не спутать с обозначением главного квантового числа:
L = 0 обозначают s; электрон находится на s подуровне;
L = 1 (p) – электрон находится на p подуровне;
L = 2 (d) – электрон находится на d подуровне;
L = 3 (f) – электрон находится на f подуровне и т.д.
Состояние электрона, характеризуемое значениями n и L, записывается электронной формулой.
Например,электрон находится на 4 энергетическом уровне (n = 4) и подуровне, характеризуемым L = 3. Состояние электрона, можно записать электронной формулой 4f.
Из взаимосвязи главного и орбитального квантовых чисел можно определить возможное число подуровней на энергетическом уровне:
I энергетический уровень (n = 1, L = 0) содержит 1 подуровень. Электронная формула электронов на I уровне 1s;,
II энергетический уровень (n = 2, L = 0, 1) содержит 2 подуровня. Электронная формула электронов на II уровне 2s2p;
III энергетический уровень (n = 3, L = 0, 1, 2) содержит 3 подуровня. Электронная формула электронов на III уровне 3s3p3d;
IV энергетический уровень (n = 4, L = 0, 1, 2,3) содержит 4 подуровня. Электронная формула электронов на IV уровне 4s4p4d4f и т.д.
В пределах одного энергетического уровня наименьшей энергией обладают электроны на s-подуровне (s-электроны). Повышение энергии по подуровням происходит в последовательности:
s < p < d < f < и.т.д.
Орбиталь электрона на s-подуровне (s-электроны) имеет сферическую форму, орбиталь p-электрона - симметричную гантель, у других (d-, f-электроны) орбитали имеют более сложную конфигурацию.
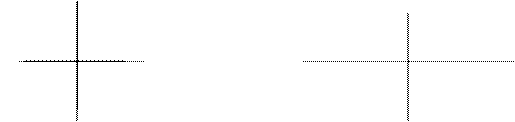
а в
Рис. 1 Формы орбиталей s –электрона (a) и p – электрона (в)
m - магнитное квантовое число. Определяет возможное число орбиталей на подуровне, а также пространственное расположение орбиталей. Может принимать значение целых чисел от + L до – L, включая нуль (+L…0…-L).
Возможное число орбиталей для подуровней:
L = 0(s) m = 0 одна s-орбиталь,
L = 1(p) m = 1,0,-1 три p-орбитали,
L = 2(d) m = 2,1,0,-1,-2 пять d-орбиталей,
L = 3(f) m = 3,2,1,0,-1,-2,-3 семь f-орбиталей и т. д.
Для р-орбиталей ось гантели расположена по осям X,Y,Z.
 |  | ||||
 | |||||
S -спиновое квантовое число. Определяет вращение электрона вокруг собственной оси. Это вращение по часовой стрелке или против неё. Может принимать значения +1/2 или –1/2.
Строение многоэлектронных атомов
 Согласно решениям волнового уравнения Шредингера (квантовым числам) в многоэлектронных атомах электроны располагаются по энергетическим уровням (n), подуровням (L) и орбиталям (m). Если орбиталь обозначим в виде ячейки,
Согласно решениям волнового уравнения Шредингера (квантовым числам) в многоэлектронных атомах электроны располагаются по энергетическим уровням (n), подуровням (L) и орбиталям (m). Если орбиталь обозначим в виде ячейки,
то структуру электронной оболочки можно изобразить электронной схемой:
 1 энергетический уровень: 1
1 энергетический уровень: 1
s
 |
2 энергетический уровень: 2 p
s








 3 энергетический уровень: 3 p d
3 энергетический уровень: 3 p d
s 














 4 энергетический уровень: 4 p d f
4 энергетический уровень: 4 p d f
s и т.д.
Рассмотрим последовательность заполнения электронами полученной структуры электронной оболочки.
В соответствии с принципом Паули «в атоме не может быть двух электронов, обладающих одинаковым набором четырёх квантовых чисел». Отсюда следует, что на одной орбитали максимально может находиться только два электрона с противоположными спинами:
на 1 энергетическом уровне находится 2 электрона 1s2;
на 2 энергетическом уровне находится 8 электронов 2s22р6;
на 3 энергетическом уровне находится 18 электронов 3s23р63d10;
на 4 энергетическом уровне находится 32 электрона 4s24р64d104f14 и т.д.
Заполнение электронной оболочки атома происходит по принципунаименьшей энергии: «Электроны в основном состоянии заполняют орбитали в порядке повышения уровня энергии орбиталей».
Энергия состояния электрона (орбитали электрона) определяется энергией уровня и подуровня. Для определения порядка заполнения электронной оболочки используют правило В. Клечковского.
«Увеличение энергии и заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n +L). При равных значениях суммы (n+L) заполняется орбиталь с меньшим значением главного квантового числа».
Например, определить порядок заполнения электронами состояний, характеризуемых электронными формулами 5d, 6p, 6s.
5d = 5 + 2 = 7; 6p = 6 + 1 = 7; 6s = 6 + 0 = 6.
Порядок заполнения 6s,5d,6р.
Заполнение орбиталей внутри одного подуровня происходит по правилу Хунда:
«Каждая орбиталь заполняется вначале одним электроном, а затем происходит их заполнение вторым электроном».

 Например, на 4p–подуровне 3 электрона (4p3) располагаются:
Например, на 4p–подуровне 3 электрона (4p3) располагаются:
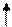




 4
4
р
Таким образом, построенная согласно квантовым числам, структура электронной оболочки
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f 5g
6s 6p 6d 6f 6g 6h и т.д.
будет заполняться согласно принципу наименьшей энергии (правилу Клечковского) для атома, например элемента свинца в следующей последовательности
82Pb 1s2
2s22p6
3s23p6
4s23d104p6
5s24d105p6
6s24f145d106p2
Электронные оболочки атомов элементов записываются в виде электронных формул:
82Pb 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p2
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 617; Нарушение авторских прав?; Мы поможем в написании вашей работы!