
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические источники электрической энергии
|
|
|
|
Химические источники электрической энергии (ХИЭЭ) – устройства, преобразующие энергию химической реакции в электрическую энергию.
ХИЭЭ, в которых протекают необратимые окислительно-восстановительные реакции (используются однократно), называются гальваническими элементами. ХИЭЭ, в которых протекают обратимые окислительно-восстановительные реакции (допускают многократное использование), называются аккумуляторами.
Гальванический элемент. Самый первый гальванический элемент Якоби-Даниэля состоит из цинкового электрода (цинковой пластинки, опущенной в раствор сульфата цинка) и медного электрода (медной пластинки, опущенной в раствор сульфата меди). Обе пластинки соединены проводником, а сосуды с раствором – электролитическим мостиком (трубка с раствором соли).
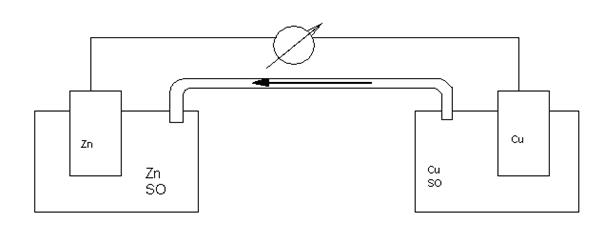
Рис. 3. Схема гальванического элемента Якоби-Даниэля
По отклонению стрелки гальванометра можно судить, что по внешней цепи идет электрический ток.
При работе цинкового электрода на поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие Zn <=> Zn2+ + 2e-.
При работе медного электрода на поверхности медной пластины возникает двойной электрический слой и также устанавливается равновесие Cu <=> Cu2+ + 2е-.
Так как цинковый электрод имеет более низкое значение электродного потенциала (–0,76 В), чем медный электрод (+0,34 В), то на цинковом электроде легче идет окисление, поэтому больше накапливается свободных электронов. Поэтому при замыкании внешней цепи электроны будут переходить от цинкового электрода к медному электроду и равновесное состояние процессов окисления и восстановления на электродах нарушится.
В результате замыкания электродов по внешней цепи на цинковом электроде равновесие сместится вправо – т. е. в раствор переходит дополнительное количество ионов цинка. Будет наблюдаться растворение цинковой пластинки. На цинковом электроде протекает процесс окисления
Zn – 2e- = Zn2+.
В то же время медный электрод принимает электроны из внешней цепи и на нем также смещается равновесие, только в обратную сторону (влево). Ионы меди из раствора выделяются в виде атомов на медной пластине. На медном электроде идет процесс восстановления
Cu2+ + 2е- = Cu.
В электрохимии электрод, на котором идет процесс окисления (отдача электронов), называется анодом. В гальваническом элементе анод имеет заряд (−).
Электрод, на котором протекает процесс восстановления (принятие электронов), называется катодом. Катод в гальваническом элементе имеет заряд (+).
Первоначально в растворах электролитов (цинковый и медный электроды) наблюдалось равенство катионов металлов (Zn2+, Cu2+) и сульфат-ионов (SO42-). Однако в процессе работы гальванического элемента в цинковом электроде раствор заряжается положительно, т.к. катионы цинка переходят в раствор с цинковой пластины Zn – 2e- = Zn2+.
На медном электроде, наоборот, катионы меди, переходя из раствора на медную пластину, заряжают раствор отрицательно за счет появления избытка сульфат-ионов Cu2+ + 2е- = Cu. Поэтому в элементе наблюдается направленное движение ионов (SO42-) от медного электрода к цинковому электроду через электролитический мостик.
При работе гальванического элемента имеет место: движение электронов по внешней цепи – электронная проводимость; движение ионов в растворе – ионная проводимость.
Суммарное уравнение окислительно-восстановительной реакции (ОВР), протекающей в гальваническом элементе, запишется:
ионное уравнение – Zn + Cu2+ = Zn2+ + Cu;
молекулярное уравнение – Zn + CuSO4 = ZnSO4 + Cu.
Гальванический элемент записывают в виде электрохимической схемы. Электрохимическая схема элемента Якоби – Даниэля
А (−) Zn | ZnSO4 || CuSO4 | Cu (+) K.
Краткая схема
А (−) Zn | Zn2+ || Cu2+ | Cu (+) K
Максимальное напряжение, которое дает элемент (Э.Д.С.), рассчитывают как разность электродных потенциалов катода и анода:
E = е катода - е анода.
Э. Д. С. элемента Якоби – Даниэля для стандартных условий
e0Zn/Zn2+ = – 0,76 (В); e0Cu/C2+ = +0,34 В
Е0 = (+0,34) – (-0,76) = 1,10 В
В гальваническом элементе окислительно-восстановительный процесс протекает самопроизвольно в направлении той реакции, для которой Э. Д. С. реакции – величина положительная.
Так как электродный потенциал зависит от концентрации ионов металлов в растворе, то можно составлять концентрационные гальванические элементы. Например, электрохимическая схема серебряного концентрационного гальванического элемента запишется
А (−) Ag | AgNO3 (С1) || (С2) AgNO3 | Ag (+) K
где С1 < С2,
C1 и C2 – концентрации электролита AgNO3.
Пример 3. Гальванический элемент составлен из алюминиевого электрода (концентрация ионов Al3+ равна 10–4 мол/л) и никелевого электрода при стандартных условиях. Составить электрохимическую схему элемента. Указать электроды, являющиеся анодом и катодом. Рассчитать Э.Д.С. гальванического элемента. Написать уравнение окислительно-восстановительной реакции, протекающей в элементе.
Решение. Из таблицы 5 находим, что значение стандартного электродного потенциала никелевого электрода е0 Ni/Ni2+ равно – 0,25(В).
По уравнению Нернста рассчитаем электродный потенциал для алюминиевого электрода
еAl/Al3+ = –1,660 + 0,059 Lg 0,0001 /3 = –1,739(В).
Чем ниже значение электродного потенциала, тем легче идет процесс окисления. В электрохимии электрод, на котором идет процесс окисления, называется анодом. В гальваническом элементе анод имеет заряд (−). Алюминиевый электрод имеет меньший электродный потенциал и является анодом. Составим электрохимическую схему элемента.
А (−) Al | Al3+ || Ni2+ | Ni (+) K.
Э.Д.С. алюминий–никелевого гальванического элемента будет равна
E = е катода – е анода = (+0,34) – (–0,76) = 1,10 В.
На алюминиевом электроде (аноде) протекает процесс окисления
Al – 3e- = Al3+.
На никелевом электроде (катоде) идет процесс восстановления
Ni2+ + 2е- = Ni.
Суммарное ионное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе, запишется:
 2 Al – 3e- = Al3+.
2 Al – 3e- = Al3+.
3 Ni2+ + 2е- = Ni
2Al +3Ni2+ = 2Al3+. + 3Ni.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1688; Нарушение авторских прав?; Мы поможем в написании вашей работы!