
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
V. Электрохимические процессы
|
|
|
|
При окислительно–восстановительных реакциях (ОВР) происходит переход электронов от восстановителя к окислителю.
Если осуществить ОВР так, что полуреакции окисления и восстановления будут пространственно разделены, то, если соединить восстановитель и окислитель электронным проводником (металлическим проводником), мы получим направленное движение электронов – электрический ток.
Химические процессы, которые сопровождаются возникновением электрического тока или протекают под действием электрического тока, называются электрохимическими процессами.
Электрохимический процесс, в котором химическая энергия превращается в электрическую энергию, протекает в химических источниках электрической энергии ( гальванический элемент, аккумулятор, топливный элемент).
Электрохимический процесс, в котором электрическая энергия внешнего источника превращается в химическую энергию (окислительно-восстановительная реакция), называется электролизом.
Прежде чем разобрать закономерности процессов, протекающих в химических источниках электрической энергии и при электролизе, рассмотрим понятие электродный потенциал.
Опустим металлическую пластинку (например, цинковую пластинку) в водный раствор собственной соли (раствор сульфата цинка). Простые вещества – металлы имеют атомную структуру (см. строение вещества). В узлах кристаллов расположены атомы и положительно заряженные ионы, связанные делокализованными (не принадлежащими конкретному атому).
При погружении металла в водный раствор полярные молекулы воды взаимодействуют с поверхностными катионами металла. В результате взаимодействия происходит вырывание положительных ионов из металла, а электроны остаются в кристалле металла. Металл, в котором остались электроны, становится заряженным отрицательно, а раствор, в который перешли положительно заряженные ионы металла, заряжается положительно. Ионы из раствора притягиваются к отрицательно заряженной поверхности металла, однако оболочка из молекул воды (гидратная оболочка) препятствует их взаимодействию. Поэтому положительно заряженные ионы металла концентрируются у поверхности.
В результате этих процессов на границе «металл – раствор» возникает разность потенциалов (двойной электрический слой).
Разность потенциалов на границе «металл – раствор» называется электродным потенциалом, а система «металл – раствор» называется электродом.


 e− Н2О·Men+ − +
e− Н2О·Men+ − +
e− Н2О·Men+ − +
e− Н2О·Men+ − +
Металл e− Н2О·Men+ раствор Металл − + раствор

Данный процесс является обратимым. Процесс перехода ионов из кристалла металла в раствор – это реакция окисления; обратный процесс перехода ионов из раствора до атомов металла – реакция восстановления.
окисление
 Me Me n+ + ne-
Me Me n+ + ne-
восстановление
Равновесие имеет динамический характер. В зависимости от условий процесс смещается в сторону процесса окисления или процесса восстановления. Потенциал, устанавливающийся в условиях равновесия реакций окисления и восстановления на электроде, называется равновесным электродным потенциалом.
Электрод, на котором идет процесс окисления, записывают формулой
Ме/Меn+.
Электрод, на котором идет процесс восстановления, записывают формулой
Меn+/Ме.
На величину электродного потенциала влияют:
- природа металла;
- концентрация катионов, в растворе электролита;
- температура.
Количественно эта зависимость выражается уравнением Нернста
е = е0 + RT Ln [Меn+] /nF,
где е – равновесный электродный потенциал, В;
е0 – стандартный электродный потенциал, В;
R – универсальная газовая постоянная, 8,31 Дж/мол 0К;
Т – температура, 0К;
[Меn+] – концентрация ионов в растворе, мол/л;
n – число электронов, принимающих участие в процессе (равно заряду иона);
F – постоянная Фарадея, 96,500 Кл/мол.
При температуре 250С (298 0К), подставляя значения RT/F и преобразовав Ln [Меn+] в Lg [Меn+], получим уравнение Нернста
е = е0 + 0,059 Lg [Меn+] /n,
где е0 – cтандартный электродный потенциал – потенциал данного электрода в стандартных условиях.
Стандартные условия в электрохимии:
– концентрация ионов в растворе 1,0 мол/л;
– температура 298 0К.
Абсолютное значение электродного потенциала экспериментально определить невозможно. Определяют относительные значенияэлектродных потенциалов по водородной шкале. За нуль принято значение стандартного электродного потенциала водородного электрода.
 2Н+ + 2е- Н2, е0 2Н+/ Н2= 0 (В).
2Н+ + 2е- Н2, е0 2Н+/ Н2= 0 (В).
Для определения электродного потенциала соответствующего электрода составляют гальванический элемент из испытуемого электрода (например Zn/Zn2+) и стандартного водородного электрода (2Н+/Н2). Измеряют Э. Д. С. (электродвижущую силу) элемента:
Э. Д. С. = е02Н+/Н2 – е0Zn/Zn2+
+0,76 = 0 – е0Zn/Zn2+
e0Zn/Zn2+ = – 0,76(В)
Стандартный электродный потенциал цинкового электрода равен – 0,76(В)
На практике в качестве электрода сравнения используется каломельный электрод. Потенциал насыщенного каломельного электрода при 25 0С равен +0,244 (В).
Если расположить электроды в ряд в порядке возрастания потенциалов, то получим ряд стандартных электродных потенциалов (см. табл. 5).
Представленный ряд стандартных электродных потенциалов дает количественную электрохимическую характеристику металлических элементов:
I.С понижением величины электродного потенциала возрастает способность атома металла окисляться до иона:
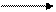 Ме – ne- Men+
Ме – ne- Men+
Fe – 2e- = Fe2+, е0Fe/Fe2+ = – 0,44 (В),
Zn – 2e- = Zn2+, e0Zn/Zn2+ = – 0,76 (В).
Атомы цинка легче окисляются, чем атомы железа.
II.С увеличением величины электродного потенциала возрастает способность ионов металла восстанавливаться до атома:
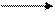 Меn+ + ne- Me
Меn+ + ne- Me
Fe2+ + 2e- = Fe, е0Fe/Fe2+ = – 0,44 (В),
Zn2+ + 2e- = Zn, e0Zn/Zn2+ = – 0,76 (В).
Ионы железа легче восстанавливаются, чем ионы цинка.
Пример 1. На каком из электродов легче пойдет процесс окисления: свинцовом с концентрацией ионов 0,001 мол/л или оловянном с концентрацией ионов 0,1 мол/л?
Решение. Чем ниже значение электродного потенциала, тем легче идет процесс окисления. Электродный потенциал зависит от концентрации ионов в растворе. Эта зависимость выражается уравнением Нернста для стандартной температуры:
е = е0 + 0,059 Lg [Меn+] /n.
Рассчитаем электродный потенциал для свинцового электрода
еPb/Pb2+ = – 0,127 + 0,059 Lg 0,001 /2 = – 0,2155(В).
Рассчитаем электродный потенциал для оловянного электрода
еSn/Sn2+ = – 0,136 + 0,059 Lg 0,1 /2 = – 0,1655(В).
Следовательно, при заданных концентрациях ионов в растворе на оловянном электроде окисление пойдет легче, чем на свинцовом электроде.
Пример 2. Рассчитать концентрацию ионов водорода (Н+) в растворе, если электродный потенциал водородного электродаравен (– 0,826 В).
Решение. Значение стандартного водородного электрода равно 0,0(В). На основании уравнения Нернста можем записать
– 0,826 В = 0,0 + Lg [Н+] /1.
Lg [Н+] = – 0,826 / 0,059 = –14.
Концентрация ионов Н+ в растворе равна 10-14 мол/л.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 790; Нарушение авторских прав?; Мы поможем в написании вашей работы!