
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Неэлектролиты и электролиты
|
|
|
|
Свойства растворов относятся к коллигативным свойствам, т.е. к таким свойствам, которые зависят от концентрации частиц в растворе. Изучение свойств растворов различных веществ показало, что для большинства растворов наблюдаются отклонения от закона Р. Рауля.
Например, при растворении 0,1 моля хлорида натрия в 1000 г воды понижение температуры замерзания раствора составило не 0,186о, а 0,318о, т.е. примерно в 2 раза больше теории.
Ван-Гофф ввел в уравнение Р.Рауля поправочный коэффициент, который назвал изотоническим коэффициентом – отношение наблюдаемого значения к расчетному значению.
Полученные экспериментальные данные привели к выводу, что при растворении вещества происходит распад (диссоциация) молекул (кристаллов) растворенного вещества в растворе на более мелкие частицы (ионы).
Растворы, в которых не происходит диссоциация растворенного вещества на ионы, называются растворами неэлектролитов. Система характеризуется отсутствием ионов в растворе и не обладает ионной проводимостью.
Растворы, в которых растворенное вещество распадается на ионы, называются растворами электролитов. Растворы электролитов являются ионными проводниками.
Описание процесса диссоциации изложено в т еории электролитической диссоциации, созданной С. Аррениусом. Основные положения этой теории:
1.При растворении электролитов происходит диссоциация (распад) их молекул на заряженные частицы – ионы.
2.При диссоциации устанавливается термодинамическое равновесие между образовавшимися ионами и молекулами.
3.Величина заряда иона совпадает с валентностью атома элемента или кислотного остатка, а число положительных зарядов равно числу отрицательных зарядов.
4.В целом раствор нейтрален. Растворы электролитов проводят электрический ток. Они являются проводниками «второго рода».
Согласно современной теории растворов, диссоциация происходит в результате взаимодействия структурных частиц растворённого вещества (молекул, ионов) с молекулами растворителя. Хорошо диссоциируют вещества с ионной и ковалентной полярной связью. Неполярные и малополярные вещества не диссоциируют или диссоциируют очень мало. На диссоциацию электролитов в значительной степени влияет полярность растворителя. Чем выше полярность растворителя, тем выше степень диссоциации электролита.
Диссоциация кислот:
НСl = H+ + Cl-
H2SO4 = 2H+ + SO42-
CH3COOH <=> H+ + CH3COO-
С точки зрения электролитической диссоциации, кислотами называются электролиты, образующие при диссоциации в водных растворах ионы водорода (Н+).
Диссоциация оснований:
NaOH = Na+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
NH4OH <=> NH+4 + OH-
Основаниями называются электролиты, которые при диссоциации в водном растворе образуют гидроксид-ионы (ОН-).
Диссоциация солей:
NaCl = Na+ + Cl-
NiSO4 = Ni2+ + SO42-
K3PO4 = 3K+ + PO43-.
Солями называются электролиты, которые при диссоциации в водном растворе образуют ионы металлических элементов /катионы/ (за исключением NH4+) и ионы кислотного остатка /анионы/.
Сильные и слабые электролиты
Изучение коллигативных свойств растворов электролитов показало, что в растворах присутствуют наряду с ионами и молекулы, так как диссоциация происходит не полностью, т.е.
КА <=> К+ + А- .
Долю молекул, распавшихся на ионы, характеризуют степенью диссоциации (a). Степень диссоциации – отношение числа распавшихся на ионы молекул (n) к общему числу растворённых молекул N:
a = n / N.
Например, a = 20 %. Это значит, что из 100 молекул электролита 20 молекул распалось на ионы. КА Û К+ + А- и в растворе присутствует 40 ионов, а также 80 нераспавшихся молекул. Всего в растворе будет присутствовать 120 частиц. Изотонический коэффициент равен 1,2.
Все электролиты по степени диссоциации делятся на две группы: сильные и слабые.
Электролиты, для которых при эквивалентной концентрации растворов Cн = 0,01–0,1мол/л степень диссоциации (a) больше 50% относят к сильным. Принято, что сильные электролиты при растворении в воде полностью диссоциируют на ионы (в растворе присутствуют только в виде ионов).
Электролиты, для которых при эквивалентной концентрации растворов Cн = 0,01–0,1мол/л степень диссоциации (a) меньше, 50 % относят к слабым. Принято, что слабые электролиты при растворении в воде лишь частично диссоциируют на ионы (в растворе присутствуют в основном в молекулярном виде).
К сильным электролитам относятся:
– соли, растворимые в воде;
– основания элементов I и II групп главных подгрупп Периодической системы элементов Д.И.Менделеева;
– кислоты Н2SO4, HNO3, HCl, HBr, HJ, HMnO4, HClO4, HCl03 и др.
К слабым электролитам относятся:
– соли, не растворимые в воде;
– основания не растворимые в воде, за исключением NH4OH, а также элементов I и II групп главных подгрупп;
– кислоты органические (СН3 СООН), H2S, H2SO3, H2CO3, H2SiO3, H3BO3, H3PO4.
К СЛАБЫМ ЭЛЕКТРОЛИТАМ ОТНОСИТСЯ ВОДА!!!
Слабые электролиты имеют различную степень диссоциации, которая зависит от концентрации электролита и температуры раствора.
Чтобы исключить влияние концентрации электролита для характеристики диссоциации, используют константу диссоциации.
Так как диссоциация является обратимым процессом КА <=>К+ + А–; то по закону действующих масс
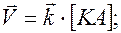
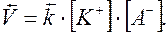
В состоянии равновесия
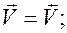


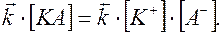 ,
,
отсюда 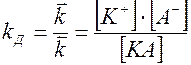 .
.
Константа равновесия в этом случае характеризует электролитическую диссоциацию электролита и называется константой диссоциации / KД /. K Д зависит от температуры и не зависит от концентрации раствора. По величине KД можно судить о силе электролита. Например, для одной и той же температуры
KД (NH4OH) = 1,79∙10-5;
KД (СН3СООН) = 1,75∙10-5;
KД (HСN) = 4,79∙10-10.
Самым слабым электролитом является HСN, имеющая наименьшее значение константы диссоциации.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1116; Нарушение авторских прав?; Мы поможем в написании вашей работы!