
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Взаимодействие металлов с кислотами
|
|
|
|
Характер взаимодействия, а также состав продуктов зависит от активности металла (восстановителя), активности кислоты (окислителя) и концентрации кислоты.
Металлы классифицируют по активности:
а) активные – электродный потенциал окисления меньше (–1,18В);
б) средней активности –электродный потенциал окисления (от –1,18В до 0,0В);
в) малоактивные – электродный потенциал окисления больше (0,0В).
Кислоты, как известно, диссоциируют на ион водорода (катион) и кислотный остаток (анион). В некоторых кислотах как катион, так и анион могут восстанавливаться. В зависимости от того, какой ион в кислоте является окислителем, возможны следующие направления реакции.
1.Взаимодействие металлов с кислотами, в которых окислителем является ион водорода (H+). Это все кислоты, кроме азотной кислоты и концентрированной серной кислоты.
Восстановление окислителя идет по уравнению
2H+ + 2e = H2.
Электродный потенциал восстановления ионов водорода в стандартных условиях будет равен 0,0В. С такими кислотами взаимодействуют все металлы, электродный потенциал окисления которых меньше нуля.
Пример 4. Составить уравнение реакции в случае возможностивзаимодействия цинка с хлороводородной кислотой.
Решение.
 1 Zn – 2e = Zn2+ e 0 = –0,74В
1 Zn – 2e = Zn2+ e 0 = –0,74В
1 2H + + 2e = H2 e0 = +0,00В

Zn + 2H += H2 + Zn2+
Zn + 2HCl = H2 + ZnCl2.
Э.Д.С. = (–0,00В) – (–0,74В) = +0,74В. Реакция протекает с образованием водорода и хлорида цинка, растворимого в воде
Если образующиеся по реакции соли нерастворимы в воде, то защитный слой разделяет реагенты и происходит пассивация металла.
 Pb + H2SO4 (разбавленная) = H2 + PbSO4.
Pb + H2SO4 (разбавленная) = H2 + PbSO4.
2.При взаимодействии металлов с концентрированной серной кислотой окислителем является сульфат-ион (SO42-).
Восстановление окислителя идет по уравнениям:
SO42- + 10H+ + 8e = H2S + 4H2O e0 = +0,30В,
SO42- + 8H+ + 6e = S + 4H2O e0 = +0,36В,
SO42- + 4H+ + 2e = SO2 + 2H2O e0 = +0,72В.
С концентрированной серной кислотой взаимодействуют все металлы до серебра, электродный потенциал окисления которого +0,80В. Состав продуктов зависит от активности металла.
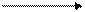 H2SO4(конц.) + Me (активн.) H2S + Me2(SO4)n + H2O
H2SO4(конц.) + Me (активн.) H2S + Me2(SO4)n + H2O
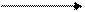 H2SO4(конц.) + Me (среднеактивн.) S + Me2(SO4)n + H2O
H2SO4(конц.) + Me (среднеактивн.) S + Me2(SO4)n + H2O
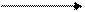 H2SO4(конц.) + Me (малоактивн.) SO2 + Me2(SO4)n + H2O
H2SO4(конц.) + Me (малоактивн.) SO2 + Me2(SO4)n + H2O
Пример 5. Составить уравнение реакции в случае возможностивзаимодействия цинка с концентрированной серной кислотой.
Решение. Цинк относиться к среднеактивным металлам
 3 Zn – 2e = Zn2+ e 0 = –0,74В
3 Zn – 2e = Zn2+ e 0 = –0,74В
 1 SO42- + 8H+ + 6e = S + 4H2O e0 = +0,36В
1 SO42- + 8H+ + 6e = S + 4H2O e0 = +0,36В
3Zn + SO42- + 8H+ = 3Zn2+ + S + 4H2O
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O.
Э.Д.С. = (+0,36В) – (–0,74В) = +1,10В. Реакция протекает с образованием серы.
3.При взаимодействии металлов с азотной кислотой любой концентрации окислителем является нитрат-ион (NO3-).
Восстановление окислителя идет по уравнениям:
2NO3- + 12H+ + 10e = N2 + 6H2O e0 = +1,27В,
2NO3- + 10H+ + 8e = N2O + 5H2O e0 = +1,12В,
NO3- + 4H+ + 3e = NO + 2H2O e0 = +0,96В,
NO3- + 2H+ + 2e = NO2 + H2O e0 = +1,05В,
NO3- + 10H+ + 8e = NH4+ + 3H2O e0 = +0,86В.
С азотной кислотой взаимодействуют все металлы до золота, электродный потенциал окисления которого +1.50В. Причем разбавленная кислота является более сильным окислителем, чем концентрированная кислота.
Состав продуктов зависит от активности металла и концентрации кислоты.
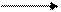 HNO3(конц.) + Me(различн.активн.) NO2 + Me(NO3)n + H2O,
HNO3(конц.) + Me(различн.активн.) NO2 + Me(NO3)n + H2O,
 HNO3(очень разб.) + Me(активн.) NH4NO3 + Me(NO3)n + H2O,
HNO3(очень разб.) + Me(активн.) NH4NO3 + Me(NO3)n + H2O,
 HNO3(разб.) + Me(активн.) N2 + Me(NO3)n + H2O,
HNO3(разб.) + Me(активн.) N2 + Me(NO3)n + H2O,
 HNO3(разб.) + Me(среднеактивн.) N2O + Me(NO3)n+H2O,
HNO3(разб.) + Me(среднеактивн.) N2O + Me(NO3)n+H2O,
 HNO3(разб.) + Me(малоактивн.) NO + Me(NO3)n + H2O.
HNO3(разб.) + Me(малоактивн.) NO + Me(NO3)n + H2O.
Пример 6. Составить уравнение реакции в случае возможностивзаимодействия цинка с разбавленной азотной кислотой.
Решение. Цинк относиться к среднеактивным металлам
 4 Zn – 2e = Zn2+ e 0 = –0,74В
4 Zn – 2e = Zn2+ e 0 = –0,74В
1 2NO3- +10H+ + 8e = N2O + 5H2O e0 = +1,12В.

4Zn + 2NO3- + 10H+ = 4Zn2+ + N2O + 5H2O
4Zn + 10HNO3 = 4Zn(NO3)2 + N2O + 5H2O
Э.Д.С. = (+1,12В) – (–0,74В) = +1,86В. Реакция протекает с образованием оксида азота (I).
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1551; Нарушение авторских прав?; Мы поможем в написании вашей работы!