
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические типы кристаллических решеток
|
|
|
|
В зависимости от природы частиц, помещающихся в узлах кристаллической решетки, и от характера сил взаимодействия между ними различаются четыре типа кристаллических решеток (четыре типа кристаллов): ионные, атомные, металлические и молекулярные.
1. Ионные кристаллы. В узлах кристаллической решетки помещаются ионы разных знаков. Силы взаимодействия между ними являются в основном электрическим (кулоновскими). Связь, обусловленная электрическими силами притяжения между разноименно заряженными ионами, называется гетерополярной или ионной.
 Типичным примером ионной решетки, может служить, изображенная на рис.17.17, решетка поваренной соли NaCl. Эта решетка принадлежит к кубической системе. Белыми кружками изображены несущие положительный заряд ионы натрия, черными кружками – отрицательные ионы хлора. Ионный кристалл состоит не из молекул, а из ионов. Весь кристалл в целом можно рассматривать как одну гигантскую молекулу.
Типичным примером ионной решетки, может служить, изображенная на рис.17.17, решетка поваренной соли NaCl. Эта решетка принадлежит к кубической системе. Белыми кружками изображены несущие положительный заряд ионы натрия, черными кружками – отрицательные ионы хлора. Ионный кристалл состоит не из молекул, а из ионов. Весь кристалл в целом можно рассматривать как одну гигантскую молекулу.
2. Атомные кристаллы. В узлах кристаллической решетки помещаются нейтральные атомы. Связь частиц в таких кристаллах называется ковалентной. Силы взаимодействия между частицами имеют также электрический, но не кулоновский механизм. Эта связь осуществляется электронными парами. Ковалентная связь может осуществляться только валентными, т. е. наименее связанными с атомом электронами. Поскольку каждый электрон каждый электрон может обеспечить связь только с одним атомом, число связей, в которых может участвовать данный атом равно его валентности.
 Типичными примерами атомных кристаллов могут служить полупроводники – германий Ge и кремний Si. Для этой решетки характерно то, что каждый атом окружен четырьмя равноотстоящими от него соседями (рис.17.18), расположенными в вершинах правильного тетраэдра.
Типичными примерами атомных кристаллов могут служить полупроводники – германий Ge и кремний Si. Для этой решетки характерно то, что каждый атом окружен четырьмя равноотстоящими от него соседями (рис.17.18), расположенными в вершинах правильного тетраэдра.
Каждый из четырех валентных электронов входит в электронную пару, связывающую данный атом с одним из соседей.
3. Металлические кристаллы. Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно движутся электроны (электронный газ), отщепившиеся от атомов при образовании ионов. Эти электроны играют роль «цементирующего материала», не давая разлететься положительным ионам. В противном случае решетка распалась бы под действием сил отталкивания между ионами.
4. Молекулярные кристаллы. В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. В данном случае силы связи между частицами – это вандерваальсовы силы притяжения между молекулами, которые учитывались нами при получении уравнения состояния реальных газов. Молекулярные решетки образуют, например, следующие вещества:  . Таким образом, обычный лед, а также так называемый сухой лед /твердая углекислота/ представляют собой молекулярные кристаллы.
. Таким образом, обычный лед, а также так называемый сухой лед /твердая углекислота/ представляют собой молекулярные кристаллы.
Кристаллическое состояние наночастиц в зависимости от поверхностного натяжения
Остановимся на основных положениях теории поверхностного натяжения.
Эффекты поверхностного натяжения обусловлены наличием молекулярного давления со стороны поверхностного слоя жидкости на остальные слои. Для того, чтобы растянутую пленку удержать в равновесии, нормально к линии ее границы, надо приложить силу f, касательную к поверхности жидкости, называемую силой поверхностного натяжения. Эта сила пропорциональна длине границы пленки l:
f = σ ∙ l,
коэффициент σ, зависящий от природы жидкости, называется коэффициентом поверхностного натяжения.
С повышением температуры коэффициент σ убывает. При приближении температуры жидкости к критической температуре σ →0.
Для увеличения поверхности жидкости на ΔS необходимо совершить работу
ΔА = σ∙ΔS.
Эта работа идет на увеличение энергии пленки ΔW, откуда
ΔW = σ∙ΔS.
Единицы размерности: [ σ ]= Н/м=Дж/м2.
Любая поверхность раздела сред обладает свободной энергией, которая пропорциональна ее площади S:

| (1) |
Разумеется, подобные выражения (1) должны быть записаны для всех поверхностей, присутствующих в системе. В равновесном положении свободная энергия минимальна, поэтому поверхности раздела сред приобретают такую форму, чтобы уменьшить суммарное значение W.
Рассмотрим два приложения этого принципа, которые, к тому же, дадут нам не только интуитивное понимание явлений, но и снабдят необходимыми формулами.

|
| Рис. 1. Краевой угол в случае, когда одна из поверхностей твердая. |
Для линии раздела для трех данных сред существует так называемый краевой угол θ (рис. 1). Угол 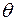 , проведенный между касательными к поверхности жидкости и к поверхности твердого тела через жидкость, называется краевым углом.
, проведенный между касательными к поверхности жидкости и к поверхности твердого тела через жидкость, называется краевым углом.
Если одна из поверхностей твердая, то действует соотношение Неймана [1]:
| σ13 – σ12= σ32 | (2) |
Нижние индексы показывают, какие среды разделяет поверхность с данным коэффициентом поверхностного натяжения (КПН). Формула (2) возникла как раз из требования минимальности свободной энергии. Можно проверить, что любое отклонение  от соотношения (2) приведет к изменению площадей соприкосновения сред таким образом, что W увеличится.
от соотношения (2) приведет к изменению площадей соприкосновения сред таким образом, что W увеличится.
Возможны случаи: 1) Силы взаимодействия между молекулами жидкости больше, чем между молекулами жидкости и молекулами твердого тела; 2) Силы взаимодействия между молекулами жидкости меньше, чем силы взаимодействия межу молекулами жидкости и твердого тела. В первом случае жидкость не смачивает поверхность твердого тела, во втором случае – смачивает. В случае несмачивания краевой угол тупой: 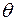 ≥ π/2, в случае смачивания
≥ π/2, в случае смачивания 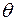 ≤ π/2. При
≤ π/2. При 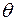 =0 говорят о полном смачивании, при
=0 говорят о полном смачивании, при 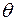 = π говорят о полном несмачивании.
= π говорят о полном несмачивании.
Давление искривленной поверхности. Рассмотрим локально плоский участок жидкой поверхности. Понятно, что любая деформация приведет к увеличению его площади, а значит, и W. Чтобы прийти к минимуму свободной энергии, искривления будут стремиться выровняться, а это как раз и говорит о возникновении давления искривленной поверхности. Соответствующая формула Лапласа для разности давлений внутри и снаружи жидкости довольно проста [1]:

| (3) |
где R1 и R2 – радиусы кривизны поверхности во взаимно перпендикулярных плоскостях.
Выводы.
На границе раздела трех сред возникает краевой угол, который определяется коэффициентами поверхностного натяжения и рассчитывается по формуле Неймана (2).
Искривленная жидкая поверхность создает дополнительное давление, рассчитываемое по формуле Лапласа (3).
Для сферы R1 = R2 = R: Р =2 σ/ R.
Для мыльного пузырька: р =4 σ/ R.
Явление изменения высоты уровня жидкости в узкой трубке (каполляре) называют капиллярностью.
Высота подъема жидкости в капилляре h рассчитывается по формуле (закон Жюрена):

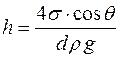 ,
,
где ρ – плотность жидкости, d - диаметр капилляра.
При полном смачивании жидкостью поверхность капилляра 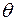 =0, cos
=0, cos 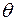 =1 данная формула принимает вид:
=1 данная формула принимает вид:
 .
.
В технике на явлении смачивания и несмачивания основана так называемая флотация. Через жидкость пропускают пузырьки воздуха. Эти пузырьки, оседая на крупинках породы, не смачиваемой жидкостью, увлекают их на поверхность жидкости. Смачиваемые же жидкостью крупинки руды погружаются на дно. Таким образом достигается отделение руды от «пустой» породы.
Задача
Рассчитать лапласовское давление в наночастице ртути с радиусом 5 нм. Для массивной капельки ртути σ = 0,465 Н/м, потому
Р =2 σ/ R = 2·0,465/5·10-9 =1,86·108 Па ≈ 2 000 атм.
Изменение кристаллической структуры. Поверхностная энергия наночастицы, обусловленная силами поверхностного натяжения, может быть заметной величиной по сравнению с объемной энергией. Для уменьшения полной энергии системы может оказаться предпочтительной такая деформация кристалла, при которой поверхностная энергия будет уменьшаться. Подобное уменьшение может быть достигнуто изменением кристаллической структуры наночастицы по сравнению с массивным образцом. Поверхностная энергия минимальна для плотно-упакованных структур, поэтому для нанокристаллических частиц наиболее предпочтительна гранецентрированная кубическая (ГЦК) или гексагональная плотно-упакованная (ГПУ) структуры. Так, нанокристаллы ниобия, молибдена и вольфрама размером 5-10 нм имеют ГЦК или ГПУ структуры, тогда как в обычном состоянии эти металлы имеют объемноцентрированную (ОЦК) решетку. Массивные кристаллические образцы гадолиния Gd имеют ГПУ структуру. Было показано, что с уменьшением размеров частиц от 110 до 24 нм в них растет содержание ГЦК фазы и уменьшается содержание ГПУ фазы. Уменьшение размеров частиц железа Fe приводит к потере кристаллической и появлению аморфной структуры.
Приложение всестороннего давления к наночастице также может приводить к уплотнению ее структуры. Причем с уменьшением размеров частицы и увеличением поверхностной энергии давление, требуемое для изменения кристаллической структуры должно расти. Такая зависимость давления от размеров наночастиц наблюдалась в коллоидных растворах. Так, обнаружено влияние размеров наночастиц сульфида свинца PbS на величину давления, приводящего к переходу из кубической в орторомбическую структуру. При уменьшении размеров наночастиц давление, при котором превращение начинается и заканчивается растет. Для наночастиц PbS размером 8.8, 5.4 и 2.6 нм превращение начинается при давлении 2.4, 3.0 и 3.3 ГПа и заканчивается при давлении 5.8, 8.0 и 9.0 ГПа соответственно.
Уменьшение размера наночастиц может приводить к росту их сжимаемости: при приложении одинакового всестороннего давления относительное уменьшение объема элементарной ячейки возрастает с уменьшением наночастиц от 8.8 нм до 2.6 нм.
Период решетки
Переход от массивных кристаллов к наночастицам сопровождается изменением межатомных расстояний и периодов кристаллической решетки. Однако, уменьшаются или увеличиваются периоды кристаллической решетки при переходе к наноразмерному масштабу и при каком размере это изменение становится заметным в экспериментальном плане остается не выясненным до конца. Обнаруженное уменьшение периода кристаллической решетки для разных элементов незначительно. При уменьшении размера частиц от 30 нм до 5 нм период решетки многих исследованных материалов уменьшается на 0,3 – 1,5 %. Вместе с тем для некоторых материалов, например, для СеО2 приводились данные противоположного характера. Наиболее надежные эксперименты не обнаруживают уменьшение периода решетки при уменьшении размера частиц до 10 нм, тогда как для частиц меньшего размера сокращение межатомных расстояний по сравнению с массивным образцом достаточно реально.
Многие авторы полагают, что уменьшение параметров решетки является следствием избыточного давления Лапласа
Р =2 σ/ R, создаваемым поверхностным натяжением σ. Согласно теории упругости относительное изменение объема 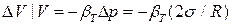 ,
,
где βТ – изотермическая сжимаемость. Этот механизм уменьшения размеров кристаллической ячейки должен бал бы быть универсальным. Однако, наблюдаются и противоположные факты.
Наиболее вероятной причиной уменьшения периода решетки малых частиц по сравнению с массивным веществом является нескомпенсированность межатомных связей атомов поверхности в отличие от атомов, расположенных внутри частицы. Отсюда происходит сокращение расстояний между атомными плоскостями вблизи поверхности частицы. Это явление носит название поверхностная релаксация.
Давление насыщенных паров над искривленной поверхностью нанокапельки.
Пусть давление насыщенных паров над плоской поверхностью жидкости  , а над искривленной границей раздела равно
, а над искривленной границей раздела равно  . Связь
. Связь  и
и  дается уравнением Томсона-Гиббса:
дается уравнением Томсона-Гиббса:
 ,
,
где v- объем конденсированной фазы, r – кривизна поверхности.
Это уравнение хорошо подтверждается опытными данными.
Температура плавления малых частиц.
Испарение жидкости, плавление твердого тела являются процессами, которые называются фазовыми превращениями (переходами).
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 1462; Нарушение авторских прав?; Мы поможем в написании вашей работы!