
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тепловое движение в кристаллах. Теплоемкость кристаллов 1 страница
|
|
|
|
Состояние вещества, между которыми происходит фазовый переход, называются фазами. В этом смысле различными фазами являются агрегатные состояния вещества: газообразное, жидкое и твердое (кристаллическое). Однако понятие фаз является более широким, чем понятие об агрегатных состояниях, так как в пределах одного и того же состояния вещества могут существовать различные фазы.
Фазовые превращения это переход вещества из одной фазы в другую, связанный с качественными изменениями свойств вещества, при изменении внешних условий. Характерной особенностью этих процессов является их скачкообразность.
В термодинамике фаза - это равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества.
Переход вещества из одной фазы в другую происходит (при заданном давлении) всегда при строго определенной температуре. Так, при атмосферном давлении лед начинает плавиться при 0 0С и при дальнейшем нагревании температура остается неизменной вплоть до момента, когда лед превратится в воду. В течение этого процесса лед и вода существуют одновременно, соприкасаясь, друг с другом. Температура, при которой происходит фазовое превращение, называется температурой фазового перехода. При температуре фазового превращения (перехода) наблюдается тепловое равновесие между двумя фазами.
В отсутствии внешних воздействий (в том числе подвода извне тепла) две фазы могут существовать неограниченно долго. При температурах выше или ниже температуры фазового перехода может существовать лишь одна (та или иная) из фаз.
При изменении давления изменяется и температура фазового перехода. Между температурой фазового перехода (превращения) вещества и давлением имеется строго определенная зависимость.
Для температуры плавления малых частиц Tm (r) при равновесии малой твердой частицы с расплавом Томсоном получена формула:
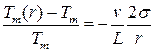 ,
,
где Tm и L – температура и удельная теплота плавления массивного твердого тела, v – удельный объем, т.е. объем 1 кг вещества (величина, обратная плотности).
Теория Томсона предсказывает универсальное уменьшение температуры плавления частиц, обратно пропорциональное их радиусу. Формулу Томсона можно представить и в таком виде:
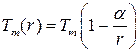 ,
,
где α – постоянная, зависящая от плотности и теплоты плавления материала и его поверхностной энергии.
Экспериментально уменьшение температуры плавления малых частиц подтверждено многими работами. В то же время по данным многих исследователей температура плавления массивных кристаллов и малых частиц радиусом > 10 нм почти не различимы. Заметное уменьшение температуры плавления наблюдается, когда размер наночастиц становится меньше 10 нм.
Узлы кристаллической решетки определяют средние положения частиц. Сами же частицы непрерывно колеблются около этих средних положений, причем интенсивность колебаний растет с температурой.
Силы притяжения между частицами сменяются быстро возрастающими с уменьшением расстояния силами отталкивания. Взаимодействие между частицами любого вида в кристалле может быть представлено потенциальной кривой, изображенной на рис.17.19. Кривая несимметрична относительно минимума. По этой причине только очень малые колебания частиц около положения равновесия будут иметь гармонический характер. С ростом амплитуды колебаний, что проис  ходит при повышении температуры, все сильнее будет проявляться ангармоничность. Это приводит, как показано на рис.17.18, к возрастанию средних расстояний между частицами и, следовательно, к увеличению объема кристалла. Так объясняется тепловое расширение кристаллов.
ходит при повышении температуры, все сильнее будет проявляться ангармоничность. Это приводит, как показано на рис.17.18, к возрастанию средних расстояний между частицами и, следовательно, к увеличению объема кристалла. Так объясняется тепловое расширение кристаллов.
При смещении частиц из положения равновесия в любом направлении появляется возвращающая сила, вследствие чего возникают колебания частицы. Каждое частице в кристалле следует приписывать три колебательные степени свободы, соответствующие трем взаимно перпендикулярным направлениям. Поскольку колебательная система характеризуется полной механической энергией, состоящей из кинетической и потенциальной энергии, то каждой колебательной степени свободы приписывается энергия 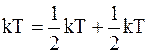 (половина kT –в расчете на кинетическую энергию, а половина kT – в расчете на потенциальную энергию).
(половина kT –в расчете на кинетическую энергию, а половина kT – в расчете на потенциальную энергию).
Следовательно, на каждую частицу (атом в атомной решетке, ион в ионной или металлической решетке) приходится в среднем энергия, равная 3kT.Энергию киломоля вещества в кристаллическом состоянии, можно получить умножением на NA: в случае химически простых веществ. В случае вещества, как, например, NaCl, число частиц составляет 2NА, так как в моле NaCl содержится NА ионов Na и NА ионов Cl.
Ограничиваясь рассмотрением химически простых веществ, образующих атомные или металлические кристаллы, для внутренней энергии киломоля вещества, получим

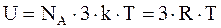 . (17.83)
. (17.83)
Теплоёмкость при постоянном объеме  кДж/кмоль К.
кДж/кмоль К.
Поскольку объем твердых тел при нагревании изменяется незначительно, их теплоемкость при постоянном давлении Сp незначительно отличается от теплоемкости при постоянном объеме Cv.
Формула (17.83) является математическим выражением закона Дюлонга и Пти, установленного опытным путем. При комнатной температуре закон выполняется в хорошем соответствии с опытом для многих веществ. Однако при низких температурах теплоемкость обнаруживает сильную зависимость от температуры, как это видно из рис.17.20. Вблизи абсолютного нуля теплоемкость всех тел пропорциональна T3, и только при температурах, близких к комнатным температурам, начинает выполняться закон (17.83). (У алмаза формула закон Дюлонга и Пти выполняется при температуре, порядка 1000˚С).
Таким образом, классическая теория теплоемкости лишь частично соответствует опытным данным. В хорошем согласии с опытом находится теория, созданная Эйнштейном и Дебаем, которая, во-первых, учитывает квантование энергии колебательного движения, а во-вторых, учитывает, что колебания частиц в кристаллической решетке не являются независимыми. Сильное взаимодействие между частицами кристалла приводит к тому, что возмущение, вызванное колебаниями какой-либо частицы, передается другим частицам и порождает в кристалле бегущую волну. Достигнув границы кристаллы, волна отражается, возникают стоячие волны. Тепловое движение в кристаллах согласно теории может быть представлено как наложение стоячих волн с целым спектром дискретных частот.
Фононный спектр и теплоемкость наночастиц
Основной причиной изменения термодинамических характеристик нанокристаллов в сравнении с массивными материалами является изменение фононного спектра. Имеет место изменение функции распределения частот атомных колебаний. В фононном спектре малых частиц появляются низкочастотные моды, отсутствующие в спектрах массивных кристаллических тел.
В малых частицах могут возникать стоячие волны, длина которых равна диаметру частицы d. Для длины стоячей волны известно соотношение:
λs = λ /2 = с/2ν = πс / ω,
Минимальная частота колебаний ωmin определяется из соотношения:
ωmin = πс/ d,
где с – скорость звука в кристалле.
Таким образом, ωmin зависит от размеров малой частицы d. Такого ограничения для массивных кристаллов нет. Можно считать, что уменьшение размеров частиц должно смещать фононный спектр в область высоких частот.
Пример: Определить значение минимальной частоты фононного спектра ν наночастицы с параметрами d =10 нм, с = 103 м/с. ν =с/2 d = 2∙103ГГц
Особенности колебательного спектра наночастиц в первую очередь отражаются на теплоемкости наночастиц и наносистем в области низких температур, которая интерпретируется квантовой статистикой Эйнштейна – Дебая.
Существует теоретическая модель, которая предсказывает спад температурной зависимости теплоемкости наночастиц при приближении к абсолютному нулю более резкий чем Т3. При Т→ 0 теплоемкость Сv (r) убывает быстрее, чем дебаевская теплоемкость Сv.
13 Методы получения магнитных жидкостей и ферросуспензий
Разработанные методы получения магнитных жидкостей дают возможность создавать разнообразные жидкости с заданными свойствами [50]. Технологии получения магнитных жидкостей хорошо отработаны и позволяют организовать массовый выпуск достаточно дешевых магнитных жидкостей с требуемыми свойствами. Созданы малоиспаряющиеся магнитные жидкости и, наоборот, обладающие высокой испаряемостью; способные смазывать поверхность и поглощать влагу из воздуха; нетоксичные — для медицинских целей и электропроводные — для электромеханических систем. Такое многообразие открывает широкие возможности применения магнитных жидкостей в технических устройствах и технологических процессах.
В состав магнитной жидкости обязательно входят три компонента: жидкая основа (или, иными словами, жидкость-носитель), магнитные частицы коллоидных размеров (магнетик) и стабилизатор, препятствующий слипанию коллоидных частиц. Каждый компонент должен удовлетворять определенным требованиям, только при этом условии можно получить магнитную жидкость, пригодную для использования в конкретном техническом устройстве [4].
Жидкую основу выбирают в зависимости от области применения. Так, в системах смазки и герметизации используют магнитные жидкости на основе минеральных масел и кремиийорганических соединений, в системах сепарации и печатающих устройствах — на основе углеводородов, в медицине — на водной основе. К жидкой основе предъявляют требования малой испаряемости, нетоксичности, стойкости в агрессивных средах, нерастворимости в тех или иных средах и т.д.
Размер магнитных частиц должен быть достаточно мал, поскольку устойчивость магнитной жидкости как коллоидной системы обеспечивается тепловым движением частиц, предотвращающим их слипание и оседание, а интенсивность такого движения возрастает с уменьшением размера частиц. В то же время частицы не должны быть слишком малы, так как при размерах менее 1-2 нм они теряют магнитные свойства, переходя в парамагнитное состояние. Материал частиц должен иметь высокую намагниченность и обеспечивать возможность получения малых частиц с небольшой дисперсией размеров.
Для грубодисперсных систем с размером частиц более 1 мкм броуновское движение не столь активно и в суспензиях с заметной вязкостью дисперсионной среды оно практически отсутствует. В этом случае определяющую роль играет скорость оседания частиц под действием силы тяжести (скорость седиментации). Скорость седиментации характеризуется законом Стокса:
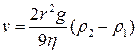 ,
,
где r - радиус частицы, ρ1 - плотность жидкости-носителя, ρ2 – плотность частицы, g - ускорение свободного падения, η - вязкость дисперсионной среды.
Седиментационная устойчивость ферросуспензий находится в зависимости от концентрации дисперсной фазы. Она обеспечивается как непосредственным структурированием системы в результате действия между частицами молекулярных сил, так и введением в систему дополнительных поверхностно активных веществ (ПАВ), которые образуют структурно – механические поверхности между частицами.
Все дисперсные системы (и микро-, и нано-) делятся условно на две группы по величине коэффициента межфазного поверхностного натяжения σ, которое может быть больше или меньше некоторого «критического» значения σс:
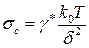 ,
,
где γ* - безразмерный множитель (γ* ~ 30), δ – средний размер частиц, Т – абсолютная температура, k0 – постоянная Больцмана. При комнатной температуре σс ~ 10-4 Н/м.
К первой группе относятся лиофильные дисперсные системы, характеризуемые низкими значениями межфазной поверхностной энергии (σ<σс). Такие системы образуются самопроизвольно за счет коллоидного растворения, при этом происходит возрастание энтропии вследствие более равномерного распределения частиц дисперсной фазы.
Ко второй группе относятся лиофобные дисперсные системы, характеризуемые высоким межфазным натяжением (σ > σс), а поэтому резко выраженной границей раздела фаз. Молекулярные силы на поверхности лиофобных частиц вызывают коагуляцию (слипание) – процесс, ведущий к агрегативной неустойчивости таких термодинамически неравновесных систем. Агрегативная устойчивость лиофобных дисперсных систем достигается путем образования на частицах адсорбционно-сольватных слоев, которые препятствуют коагуляции частиц.
Для решения данной проблемы применяют различные стабилизаторы, в качестве которых используют вещества (полимеры или ПАВ) с длинноцепочечными молекулами, содержащими функциональные группы (ООН, Н2ОН, H2NH2 и др.). Стабилизатор выбирают таким образом, чтобы его функциональные группы взаимодействовали с веществом магнитной частицы, образуя прочно связанную с ней мономолекулярную оболочку. Длинноцепочечная часть молекул стабилизатора должна быть сходна с жидкостью-носителем, чтобы участвовать в тепловом движении и тем самым предотвращать сближение частиц. Выбор стабилизатора представляет довольно сложную задачу, решаемую в основном экспериментально.
В неполярных дисперсионных средах (масло, керосин, додекан, октан и т. д.) гибкие неполярные концы ПАВ, сродственные жидкости-носителю, направлены от частицы к жидкости – рис. 13а. Устойчивость диспергированных частиц в полярной жидкости, например, в воде, достигается характерным расположением двух слоев ПАВ (рис. 13б), при этом сродственные полярной жидкости-носителю полярные концы второго слоя ПАВ направлены от частицы к жидкости. В этом случае толщина защитной оболочки вдвое превышает толщину защитной оболочки, к примеру, магнетита, стабилизированного в углеводородных средах.

Варьируя состав магнитных жидкостей, то есть выбирая жидкость-носитель, магнетик, стабилизатор, получают жидкости с необходимыми свойствами.
13.1 Получение магнитных жидкостей с различной дисперсной фазой
Для получения такой сложной среды, как магнитные жидкости, требуется решить несколько проблем. Прежде всего, необходимо получить частицы магнетика размером не более 5‑10 нм. Далее следует обеспечить покрытие частиц слоем молекул стабилизатора. И, наконец, стабилизатор должен не только предотвращать слипание частиц, но и обеспечивать образование коллоидного раствора в жидкости-носителе. Совокупное решение этих проблем позволяет получить магнитную жидкость, устойчивую в гравитационном, центробежном и магнитном полях, обладающую высокими магнитными свойствами и ведущую себя во многих отношениях как сплошная однородная среда [4]. Получение частиц необходимых размеров возможно различными методами.
Методы дробления
Первая магнитная жидкость была получена в середине 60-х годов путем размола магнетита в шаровой мельнице в присутствии раствора олеиновой кислоты в керосине. Потребовалось около трех месяцев непрерывной работы мельницы для получения устойчивой коллоидной системы, обладающей заметными магнитными свойствами. Образование частиц коллоидных размеров в шаровой мельнице происходит в результате размола магнетита стальными шарами, перекатывающимися в горизонтальном вращающемся цилиндре – рис. 13.2.

Оптимальное заполнение мельницы шарами — на 30-40% ее объема, дисперсным материалом— на 20%. Размол в присутствии жидкости-носителя и стабилизатора позволяет получить достаточно мелкие частицы и одновременно обеспечивает коллоидную устойчивость системы. При сухом помоле обычно невозможно получить частицы размером меньше 60 нм.
Получение магнитных жидкостей в шаровых мельницах имеет как достоинства, так и недостатки. Метод очень прост в реализации и позволяет достигать необходимой степени дисперсности частиц, что определяется продолжительностью размола; исключает потери растворителя, если он летуч; дает возможность получать жидкости с различными магнетиками (такими как магнетит, кобальт, никель, железо, ферриты и др.), используя при этом различные основы (керосин, углеводороды, воду, силиконы, фторорганические соединения и пр.). Однако истирающиеся шары загрязняют получаемую магнитную жидкость, а образующиеся частицы значительно различаются по размерам, что отрицательно влияет на коллоидную устойчивость жидкости.
Основной недостаток метода — длительность процесса и малый выход конечного продукта: при работе мельницы в течение нескольких недель получают 200-300 мл магнитной жидкости.
Кроме того, магнитные характеристики получаемых жидкостей относительно невелики (намагниченность насыщения около 10 кА/м), и для их увеличения жидкости выпаривают, что дополнительно понижает производительность метода. К тому же наблюдается значительный разброс частиц по размерам, что ведет к неоднозначной связи между свойствами магнитных жидкостей и их составом.
Необходимость снижения стоимости магнитных жидкостей привела к попыткам усовершенствования метода размола. К примеру, были попытки использовать вместо магнетита более хрупкий немагнитный оксид железа вюстит FeO. После размола полученный немагнитный коллоид нагревали, в результате чего он разлагался на магнетит и α-железо по уравнению
4 FeO → Fe + Fe3O4.
Таким методом получали жидкости примерно с теми же характеристиками (например, намагниченность насыщения около 10 кА/м), что и прямым размолом, но значительно быстрее.
 Кроме механического дробления можно применять другие методы разрушения материалов для получения мелкодисперсных магнитных частиц. Например, были попытки использовать ультразвуковое и электроплазменное измельчение, как и измельчение вращающимся магнитным полем или электрораспылением (рис. 13.3), что, однако, не привело к улучшению характеристик магнитных жидкостей или повышению производительности процесса. Кроме того, методы дробления применимы только к хрупким магнетикам, таким как ферриты или магнетит, намагниченность которых не очень велика. Использовать же эти методы для получения коллоидных частиц металлов, намагниченность которых в несколько раз выше, едва ли возможно из-за высокой пластичности металлов.
Кроме механического дробления можно применять другие методы разрушения материалов для получения мелкодисперсных магнитных частиц. Например, были попытки использовать ультразвуковое и электроплазменное измельчение, как и измельчение вращающимся магнитным полем или электрораспылением (рис. 13.3), что, однако, не привело к улучшению характеристик магнитных жидкостей или повышению производительности процесса. Кроме того, методы дробления применимы только к хрупким магнетикам, таким как ферриты или магнетит, намагниченность которых не очень велика. Использовать же эти методы для получения коллоидных частиц металлов, намагниченность которых в несколько раз выше, едва ли возможно из-за высокой пластичности металлов.
Методы конденсации
Частицы коллоидных размеров могут образовываться благодаря объединению (конденсации) отдельных молекул. При объединении молекул или атомов свободная энергия системы уменьшается, поэтому процесс идет самопроизвольно. На размер образующихся частиц существенно влияют условия, при которых происходит объединение отдельных молекул в частицы, поэтому для получения коллоидных частиц магнетиков используют различные варианты метода.
Исторически получение высокодисперсных магнетиков методом конденсации начали использовать для частиц металлов, то есть для получения магнитных жидкостей с высокими магнитными свойствами. Одним из первых был развит карбонильный метод, основанный на термическом разложении карбонилов металлов.
Пары карбонила металла, испаряющегося в резервуаре 1 (рис. 13.4), разбавленные инертным газом (например, азотом или аргоном), поступают в реактор 2, где при повышенной температуре происходит разложение пентакарбонила металла. При этом атомы металла объединяются в частицы, а летучие продукты разложения конденсируются в аппарате 3. Изменяя условия в реакторе (температуру, соотношение растворителя и ПАВ, их состав), можно получить частицы металлов размером от 2 до 30 нм.

Несмотря на высокую намагниченность металлов, получаемые этим методом жидкости имеют невысокие магнитные характеристики. Малая намагниченность насыщения объясняется большой толщиной слоя ПАВ, необходимого для предотвращения слипания частиц металлов с большой намагниченностью. С ростом толщины стабилизатора объемная доля магнетика падает, что приводит к падению намагниченности насыщения. Кроме того, частицы металлов, как правило, имеют несферическую форму, что ведет к усилению сил притяжения частиц (по сравнению с притяжением сферических частиц), то есть требует дополнительного увеличения слоя ПАВ. Использование недостаточно больших молекул ПАВ для стабилизации частиц может привести к агрегированию последних и расслоению жидкости при длительном хранении. Такие ограниченно устойчивые магнитные жидкости можно использовать в технических устройствах с постоянным перемешиванием.
Другой метод конденсации — электролитическая конденсация из водных растворов солей металлов частиц, которые немедленно диспергируются в жидкости-носителе в присутствии стабилизатора. Процесс проводят в двухслойной электролитической ванне с вращающимся катодом, где нижний слой — раствор электролита, верхний — раствор стабилизатора в жидкости-носителе. Катод быстро вращается, так что частицы металла, едва успев сконденсироваться из электролита на его поверхности, сразу попадают в дисперсионную среду и покрываются слоем ПАВ.
Электролитическим методом можно получать частицы металлов различной дисперсности в зависимости от скорости вращения катода, глубины его погружения, концентрации электролита, температурного режима, материала катода. Например, электролитическим методом получена магнитная жидкость [11] с частицами кобальта, имеющая намагниченность насыщения 10 кА/м, при этом частицы имели размер 30-80 нм. Малая дисперсность частиц затрудняет стабилизацию магнитной жидкости и ограничивает концентрацию магнетика. Производительность метода низка. Из-за совокупности указанных недостатков электролитический метод не нашел широкою применения.
Известен способ получения высокодисперсных порошков путем вакуумной конденсации паров металлов, нагреваемых до высоких температур. Процесс конденсации происходит преимущественно на поверхности стенок сосуда, в котором создан вакуум, и условия взаимодействия атомов металла с поверхностью играют основную роль при образовании коллоидных частиц. Однако удобно получать высокодисперсные частицы металлов конденсацией их паров непосредственно в дисперсионной среде. При этом большое значение имеет смачиваемость поверхности образовавшихся коллоидных частиц, то есть их лиофильность по отношению к жидкости-носителю. При лиофильной поверхности частицы быстро смачиваются дисперсионной средой, и их рост прекращается. Таким способом можно получать очень малые частицы.
Методы вакуумной конденсации до последнего времени не использовали для получения магнитных жидкостей ввиду сложности их реализации. Однако развитие вакуумной технологии позволило добиться хороших результатов, объединив вакуумное испарение металлов с их конденсацией в жидкости. Малые размеры и высокие магнитные свойства частиц, полученных методом вакуумного испарения, обеспечивают высокие магнитные свойства жидкостей. Образцы остаются устойчивыми в гравитационном и магнитном полях, а рентгеноструктурный анализ показывает отсутствие окислов металлов в жидкостях (за исключением некоторого количества FeO). Эти данные говорят о перспективности описанного метода получения магнитных жидкостей с металлами в качестве магнетика, хотя в существующем виде метод малопроизводителен и непригоден для широкомасштабного производства магнитных жидкостей.
Наиболее используемый сегодня вариант метода конденсации — химическая конденсация высокодисперсного магнетита, в основе которой лежит реакция
FeCl2·4H2О + 2FeCl3·6H2О +8NaOH → Fe3О4↓ + 8NaCl + 20H2О
Суть метода химического осаждения высокодисперсного магнетита заключается в быстрой нейтрализации при нагреве и постоянном перемешивании солей двух- и трехвалентного железа избытком водного раствора аммиака. Образующийся в ходе реакции осадок состоит из частиц магнетита размерами от 2 до 20 нм при среднем размере около 7 нм. Магнитные свойства частиц близки к магнитным свойствам монокристаллов магнетита; поверхность частиц обладает хорошей адсорбционной способностью, что важно для обеспечения их стабилизации.
Метод обладает существенными преимуществами по сравнению с другими методами получения высокодисперсных частиц магнетитов, рассмотренными выше. Прежде всего он высокопроизводителен — его производительность ограничена лишь емкостью химического реактора, так как сама реакция протекает очень быстро. Кроме того, он пригоден для промышленного производства и легко автоматизируется и механизируется.
13.2 Технология получения магнитной жидкости методом химической конденсации
Описываемая лабораторная установка была разработана на базе Белорусского национального технического университета [11]. Она представляет собой магнитоуправляемый реактор емкостью 3,5-4 литра из нержавеющей стали (можно также использовать стекло). Реактор состоит из цилиндрического корпуса, крышки и мешалки лопастного типа – рис. 13.5.
В крышку реактора вмонтированы штуцера, через которые осуществляется подача смеси 20% растворов солей железа (II) и железа (III) и 25% водного раствора аммиака.
Для поддержания термостабильных условий процесса предусмотрена рубашка, через которую насосом термостата прокачивают теплоноситель. Контроль температуры осуществляется хромель-копелевой термопарой, вмонтированной в крышку реактора.
Подача необходимых в процессе производства компонентов для магнитных жидкостей производится посредством трех штуцеров 7. Для эффективного перемешивания на валу реактора закреплена мешалка лопастного типа 3. Внизу реактора предусмотрен кран 6, через который сливается готовый продукт МЖ. Для разделения водной суспензии магнетита на магнетит и воду предусмотрен постоянный магнит, располагаемый под днищем реактора.

Процесс получения МЖ в ректоре включает в себя следующие стадии:
1) Получение высокодисперсного магнетита методом химического осаждения и его магнитная сепарация. Магнитная сепарация заключается в том, что под действием магнитного поля водная суспензия магнетита разделяется на 2 фракции, а именно осадок магнетита и маточный раствор, который сливается через штуцер, расположенный с боковой стороны реактора.
2) Пептизация и отбивка воды с получением пастообразного концентрата заключается добавлением к водной суспензии магнетита смеси ПАВ и небольшого количества жидкости-носителя в соотношении 1:1 при температуре 50-55 0С.
3) Обезвоживание концентрата МЖ заключается в обработке пастообразного концентрата ацетоном.
4) Диспергирование концентрата МЖ в жидкости-носителе осуществляется путем его механо-термической обработки при Т=70-80ºС.
5) Охлаждение технической МЖ до комнатной температуры.
Перечислим основные параметры процесса получения МЖ на лабораторной установке:
1) концентрация растворов солей железа (II) и железа (III) – 20 %;
2) температура процесса получения магнетита – 45 – 50°С;
3) время магнитной сепарации магнетита на магните – 2-3 минуты.
4) рН среды, при которой осуществляется пептизация осадка магнетита 12-14;
5) температура пептизации – 50-55°С;
6) продолжительность пептизации – 2-3 минуты;
7) температура диспергирования – 70-80°С;
8) время диспергирования – 1-1,5 часа;
9) охлаждение технической МЖ до температуры 25-30ºС.
10) центрифугирование технической МЖ с фактором разделения 6000g в течение 1-2 часов с получением готового продукта.
Установка предназначена для синтеза магнитных жидкостей на основе керосина, нефтяных масел, полиэтилсилоксановых жидкостей марок ПЭС-1,2,3,4 и перфторорганики. Установка достаточно универсальна и удобна в эксплуатации, ее производительность 0,2 литра за 3 часа.
13.3 Методика получения магнетита и магнитных жидкостей на трансформаторном масле и керосине
Предлагаемый способ получения магнитной жидкости включает в себя следующие стадии (расчет ведется на 25 г магнетита):
1. Приготовление раствора FeCl3·6H2O. В стакане или колбе объемом 2-3 л готовим раствор соли. С этой целью 1,6 кг FeCl3 6H2O необходимо растворить в 2 л воды и приготовленный раствор использовать многократно. Для приготовления 25 г магнетита необходимо из приготовленного раствора взять 138 мл. Срок хранения раствора 1 месяц со дня приготовления.
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 1149; Нарушение авторских прав?; Мы поможем в написании вашей работы!