
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изучение свойств соединений азота
|
|
|
|
Цель работы: познакомиться со свойствами соединений азота.
Необходимые реактивы: гидрофосфат аммония, бихромат аммония, сульфат аммония, нитрат аммония, сульфат марганца, гидроксид калия, нитрат калия, хлорид аммония, гидроксид кальция, хлористоводородная кислота, концентрированная и 1н раствор, азотная кислота, концентрированная и 30% раствор, 25% раствор гидроксида аммония, 40% и 1М растворы гидроксида натрия, 0,1М растворы сульфата меди, хлорида никеля (II), сульфата железа (II), хлорида бария, перманганата калия, нитрата натрия, реактив Несслера, металлические медь, магний, алюминий, сера элементарная, охлаждающая смесь (лед с солью).
Необходимое оборудование: пробирки, стеклянная трубка диаметром 10 мм и длиной 1 м, резиновая пробка с отводной трубкой, колба Вюрца на 100 мл, капельная воронка на резиновой пробке, фарфоровые тигли, 2 шт., мерная колба на 100 мл, коническая колба на 100 мл, бюретка на 25-50 мл, U-образные трубки, 2 шт.
3.1 Получение и разложение солей аммония.
3.1.1 Хлоридаммония. Укрепить в штативе стеклянную трубку диаметром 10 мм и длиной 1м (лапка штатива должна приходиться на середину трубки, рис.1).
HCl NH3
 |
l1 l2
Рис. 1. Прибор для наблюдения за образованием хлорида аммония.
Одновременно в один конец трубки вставить ватный тампон, смоченный концентрированным раствором соляной кислоты, в другой – смоченный концентрированным раствором аммиака. Заметить время появления отчетливого белого кольца хлорида аммония на стенке трубки. Это есть время диффузии аммиака и хлорида водорода в воздухе. Измерить расстояние по длине трубки от ватных тампонов до кольца (l 1и l 2). Убедиться в справедливости соотношения
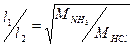
Написать уравнение реакции.
3.1.2. Аммонийные соли фосфорной кислоты. В сухую пробирку насыпать около 0,5 г гидрофосфата аммония и нагреть. Осторожно определить запах выделяющегося газа. К отверстию пробирки поднести смоченную бумажку универсального индикатора. Что наблюдается? Какое вещество остается в пробирке после нагревания? Написать уравнение реакции.
3.1.3. Бихромат аммония. В сухую пробирку насыпать около 0,5 г бихромата аммония. При инициировании реакции путем нагревания начинается бурная реакция. При этом пробирку держать вертикально. Определить, имеют ли продукты реакции запах и конденсируется ли вода на стенках пробирки. Написать уравнение реакции.
3.1.4. Сульфат аммония. В сухую пробирку поместить около 0,5 г сульфата аммония и нагреть. Что наблюдается? Написать уравнение реакции термической диссоциации сульфата аммония.
Чем объясняется различный характер разложения солей аммония при нагревании? Какие соли аммония возгоняются? Как доказать экспериментально, что использованные соли являются солями аммония?
3.2. Получение аммиакатов.
В одну пробирку налить небольшое количество раствора сульфата меди (П), в другую – раствор хлорида никеля (П) и добавить к ним по каплям раствор аммиака. Что наблюдается? Написать уравнения реакций.
3.3. Получение оксида азота (II) и изучение его свойств. (Работать под тягой!)
3.3.1. Прибор для получения оксида азота (II) показан на рис.2. В колбу Вюрца внести медные стружки и из капельной воронки прилить разбавленную азотную кислоту (30%). В пробирку собрать оксид азота (II): для этого открыть зажим и пропускать газ до тех пор, пока у отверстия пробирки не появится бурый газ. Объяснить, почему газ в пробирке бесцветен, а на воздухе он буреет.
3.3.2. Через пробирку с раствором сульфата железа (II) пропустить оксид азота (II) и нагреть пробирку. Что наблюдается? Написать уравнение реакции.
3.4. Получение оксида азота (IV) и изучение его свойств.
3.4.1. В капельную воронку (рис. 2) налить концентрированную азотную кислоту, в колбу Вюрца поместить медные стружки. К газоотводной трубке прибора присоединить U-образную трубку, поместить ее в охладительную смесь (лед с солью), туда же поставить пробирку с 3-5 мл воды. Добавить азотную кислоту к медным стружкам. Объяснить наблюдаемые явления. Каков состав жидкости, собирающейся в U-образной трубке?
 |
Отсоединить U-образную трубку, быстро вылить полученную жидкость в пробирку с охлажденной водой. Что наблюдается? Каков состав вещества, собравшегося на дне пробирки? Каков pH водного раствора в пробирке? Написать уравнения реакций.
Рис.2. Прибор для получения оксидов азота (II) и (IV).
3.4.2. Через раствор гидроксида натрия пропустить оксид азота (IV) (его получить так, как описано в п. 3.4.1) К полученному раствору добавить по каплям подкисленный раствор перманганата калия. Что наблюдается? Написать уравнения реакций.
3.5. Изучение свойств азотной кислоты и ее солей. (Работать под тягой!)
3.5.1. В две пробирки с медной и магниевой стружкой налить 1-2 мл концентрированной азотной кислоты, пробирку с медью нагреть (для инициирования реакции). Отметить окраску выделяющихся газов. Написать уравнения реакций.
3.5.2. В фарфоровый тигель внести немного порошкообразной серы и налить несколько миллилитров концентрированной азотной кислоты. Смесь кипятить на водяной бане 7-10 мин, добавляя азотную кислоту по мере ее разложения. По окончании реакции тигель охладить и его содержимое разбавить водой. По реакции с хлоридом бария доказать наличие в растворе сульфат-ионов. Написать уравнения реакций.
3.5.3. В пробирку налить 1-2 мл раствора нитрата натрия и 3-5 мл концентрированного раствора гидроксида натрия, затем добавить немного порошка алюминия. Пробирку закрыть пробкой с отводной трубкой, конец которой опустить в пробирку с реактивом Несслера и пробирку нагреть. Объяснить наблюдаемое явление. Написать уравнения реакций.
Лабораторная работа №4
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 826; Нарушение авторских прав?; Мы поможем в написании вашей работы!