
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретические сведения 2 страница
|
|
|
|
2Ga + 3Br2 = 2GaBr3 2Ga + 3S = Ga2S3
2Ga + 3I2 = 2GaI3
Валентность III, СО +3, однако у таллия есть +1. Tl2O хорошо растворима в воде:
Tl2O + H2O = 2TlOH
Гидроксид таллия (I) является сильным основанием и восстановителем.
Ga2O3, In2O3, Tl2O3 – не растворимы в воде. Гидроксиды получают косвенным путем:
TlCl3 + 3NaOH = Tl(OH)3 + 3NaCl
Ga(OH)3, In(OH)3 – амфотерны (растворяются в кислотах и щелочах). Tl(OH)3 – основание (растворяется только в кислотах).
Галлий используется в вакуумной технике и в сигнальных приборах. Вместе с индием применяют для получения очень легких коррозионно- и износоустойчивых сплавов. Таллий применяют в производстве кислотоупорных сплавов.
Углерод, кремний, германий, олово и свинец расположены в главной подгруппе IV группы ПСЭ. Электронная формула эти элементов: ns2np2:
2 s 2 р 2 s 2 р
| С6 | ¯ | | | С* | | | | |
При возбуждении один из s-электронов переходит на наружную орбиталь р-подуровня. При этом число неспаренных электронов на внешнем уровне возрастает до четырех. Следовательно, в соединениях данные элементы проявляют валентности IV и II, степени окисления: +4, +2, -4. Энергия, затрачиыаемая для перехода электрона, с избытком компенсируется энергией, выделяющейся вследствии образования четырех связей.
Сверху вниз по группе увеличивается радиус нейтральных атомов, поэтому металлические свойства усиливаются, не металлические ослабевают, активность (устойчивость) снижается. Поэтому углерод и кремний – неметаллы, германий занимает промежуточное положение, а остальные относят к металлам.
По отношению к водороду всегда четырех валентны, образуют водородные соедиения типа ЭН4, устойчивость которых в ряду С, Si, Ge, Sn, Pb уменьшается. С кислородом элементы образуют оксиды типа ЭО и ЭО2, гидроксиды, соли.
Среди всех элементов углерод занимает особое положение, так как а ПСЭ он расположен между электроположительными элементами, находящимися в левой части, и электроотрицательными элементами, находящимися в правой части таблицы. Относительная электроотрицательность углерода (2,5) равна среднеарифметической между ОЭО фтроа (4) и лития (1). Иными словами, углерод имеет равновероятную склонность, как к отдаче, так и к присоединению электронов.
Всесте со способностью образовывать ковалентные связи с другими элементами углерод обладает исключительными свойствами, заключающиеся в способности его атомов соединяться друг с друглм, образуя разнообразные цепи из атомов.
Встречается углерод в природе как в свободном состоянии (алмаз, графит), так и в виде соединений. Входит в состав всех живых организмов, составная часть каменного угля, нефти. Содержится в известняке, мраморе, меле и доломите, входит в состав углекислого газа.
Известны четыре аллотропических видоизменения углерода: алмаз, графит, карбин и поликумулен (аморфный углерод).
Алмаз – бесцветен, прозрачен, самый твердый из всех веществ. Твердость обусловлена структурой кристалла. Каждый атом углерода в кристаллической решетке соединен ковалентной связью с 4 другими атомами, находящимися на равных расстояниях и расположенными в углах правильного тетраэдра.
Графит – темно-серое кристаллическое вещество, мягок, хорошо проводит электрический ток. В кристаллической решетке атомы углерода находятся в углах правильных шестиугольников, расположенных в параллельных плоскостях, расстояния между которыми больше (рис. 5).
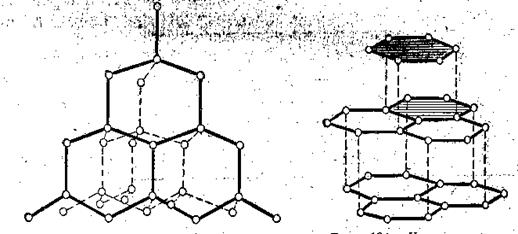
Алмаз Графит
Рис. 5. Строение алмаза и графита.
Аморфный углерод в природе не встречается. Получают из углеродистых соединений в виде древесного угля, сажи, кокса и костяного угля. Он обладает адсорбционными свойствами.
В обычных условиях углерод инертен. Реакционная способность усиливается с повышением температуры.
Взаимодействует с простыми веществами:
2С + О2 (недостаток) = 2СО
С + О2 (избыток) =СО2
C + O2 = CO = CO2
Под воздействием высоких температур углерод способен взаимодействовать с металлами, образуя карбиды:
C + Са = СаC
При температуре электрической дуги углерод способен соединяться с водородом, металлоидами и галогенами:
С + Н2 = СН4
С + 2S = CS2
При температуре 12000С взаимодействует с водой:
С + Н2О = СО + Н2
При высоких температурах углерод восстанавливает металлы из их оксидов:
С + 2ZnO = Zn + CO2
Концентрированная серная и азотная кислоты при нагревании окисляют углерод до диоксида углерода:
С + 2H2SO4 конц. = CO2+ 2SO2 + 2H2O
3С +4HNO3 конц. = 3CO2+4NO + 2H2O
Образует два кислотных оксида: СО – окись углерода (угарный газ), СО2 – дуокись углерода (углекислый газ).
СО – бесцветный газ, без запаха, плохо растворим в воде, яд. Отравляющее действие основано на том, что он небратимо взаимодействует с гемоглобином крови, которая после этого утрачивает способность переносить кислород из легких в ткани.

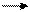 Из-за наличия в молекуле тройной связи оксид углерода (II) в химическом отношении – инертное вещество. В молекуле две ковалентные и одна донорно-акцепторная связь::С=Ö:→С = О
Из-за наличия в молекуле тройной связи оксид углерода (II) в химическом отношении – инертное вещество. В молекуле две ковалентные и одна донорно-акцепторная связь::С=Ö:→С = О
На воздухе горит характерным синим пламенем. В ОВР – восстановитель. На солнечном свету или в присутствии катализатора оксид углерода взаимодействует с хлором, образуя ядовитое вещество - фосген:
СО + Сl2 = COCl2
При нагревании до 7000С окисляется до диоксида углерода:
2СО + О2 = 2СО2
Восстанавливает многие металлы из их оксидов:
CO + CuO = Cu + CO2
Является кислотным оксидом, так как реагирует со щелочью, металлами при повышении температуры и давлении:
СО + NaOH = HCOONa
Оксид углерода (II) соединяется со многими металлами, образуя карбонилы, например, карбонил железа Fe(CO)5, карбонил никеля Ni(CO)4:
Fe + 5CO = Fe(CO)5
Степень окисления металла в карбониле равна нулю.
При нагревании до 5000С в присутствии катализатора оксид углерода взаимодействует с аммиаком с образованием синильной кислоты (цианистого водорода):
СО + NH3 = HCN + H2O
HCN - слабая одноосновная кислота (Ка = 7,9·10-10), бесцветная жидкость, летуча, сильный яд c запахом горького миндаля, ее соли- цианиды.
Оксид углерода (II) в промышленности получают:
С + О2 = СО2
СО2 + С = СО (при температуре 5000С)
В лаборатории оксид углерода получают действием концентрированной серной кислоты на муравьиную кислоту, на щавелевую кислоту, или на желтую кровяную соль:
HCOOH = CO + H2O
H2C2O4 = CO + H2O + CO2
K4[Fe(CN)6] + 6H2SO4 + 6H2O = 2K2SO4 + FeSO4 + 3(NH4)2SO4 + 6CO
Степень окисления углерода +4 проявляется в его соединениях с более электроотрицательными, чем он сам, неметаллическими элементами: СО2, CS2, CCl4, COCl2.
По химической природе эти соединения углерода (IV) являются кислотными. Некоторые из них довольно легко взаимодействуют с водой, образуя кислоты; с основными соединениям, образуя соли:
СО2 + Н2О = Н2СО3
COCl2 + 2H2O = H2CO3 + 2HCl
CO2 + 2KOH = K2CO3 + H2O
CaS + CS2 = CaCS3
Молекула СО2 линейна: О = С = О.
СО2 – бесцветный газ, растворяется в воде, под давлением превращается в жидкость, которую хранят и транспортируют в стальных баллонах. Твердую прессованную СО2 по названием «сухой лед» применяют для сохранения скоропортящихся продуктов.
При растворении в воде образует слабую двухосновную угольную кислоту. Константы ступенчатой диссоциации соответственно равны: К1 = 2·10-7, К2 = 4,8·10-11. Как двухосновная кислота, она образует два типа солей: средние - карбонаты и кислые – гидрокарбонаты:
CO2 + H2O = H2CO3
В свою очередь угольная кислота частично подвергается диссоциации. В водном растворе одновременно имеют место быть следующие равовесия:
Н2О + СО2 ↔ Н2СО3 ↔ Н+ + НСО3- ↔ 2Н+ + СО32-
При нагревании СО2 улетучивается, и равновесие смещается влево; аналогичное влияние оказывает добавление сильной кислоты. Напротив, при добавлении щелочи происходит связывание ионов водорода и смещение равновесия вправо.
Образуется углекислый газ при сжигании топлива, гниении растительных и животных останков, при дыхании, из минеральных источников.
В промышленности СО2 получают при обжиге известняка:
СаСО3 = СаО + СО2
В лаборатории – действием разбавленных кислот на карбонаты:
СаСО3 + 2HCl = CaCl2 + CO2 + H2O
В химических реакциях проявляет свойства кислотного оксида, то есть взаимодействует с основаниями, основными оксидами, при температуре с металлами:
СО2 + 2Mg = 2MgO + C
Вследствие гидролиза растворы карбонатов (растворимых в воде: Na2CO3, K2CO3 и всех гидракарбонатов), имеют щелочную реакцию среды.
Карбонаты под действием температуры легко разлагаются на оксиды соответствующего металла и углекислый газ:
MgCO3 = MgO + CO2
Исключение составляют карбонаты щелочных металлов, которые плавятся без разложения.
Гидрокарбонаты при нагревании переходят в карбонаты:
Са(НСО3)2 = СаСО3↓ + Н2О + СО2
Качественной реакцией на карбонат- и гидрокарбонат-ион является их взаимодействие с более сильными кислотами. Образовавшийся СО2 пропускают через известковую воду наблюдают ее помутнение, вследствие образования нерасторимого карбоната кальция:
СаСО3 + 2HCl = CaCl2 + CO2 + H2O
CO2 + Ca(OH)2 = CaCO3↓ +H2O
В ОВР является окислителем:
Mg + CO2 = MgO + CO
Углерод при нагревании взаимодействует с серой с образованием сероуглерода. CS2 не смешивается с водой и является хорошим растворителем жиров, смол. Его можно рассматривать как тиоангидрид. Например, при взаимодействии с Na2S образуется тиокарбонат натия (соль тиоугольной кислоты H2CS3).
Из других соединений углерода с серой отметим роданиды, которым соответствует роданистоводородная кислота H-N=C=S (HCNS). Роданиды являются реактивом на ионы трехвалентного железа.
Известно большое количество соединений углерода с другими элементами: галогенами, азотом, бором, где степень окисления углерода +4. Простейшие соединения углерода с галогенами отвечает общей формуле СГ4. Большое практическое применение находит четыреххлористый углерод, являющийся хорошим растворителем жиров и смол. Преимущество его перед CS2 в том, что он не горюч. Большое применение в холодильных установках находят смешанные галогениды углерода. В технике они известны под названием «хладоны» (фреоны).
К соединениям со степенью окисления -4 относят карбиды и всю органику (метан, этилен, ацетилен и т.д.).
Углерод – основа всех органических соединений. Организму необходимы также неорганические соединения углерода: CO2, NaHCO3. СО2 применяется при получении соды, в производстве сахара и газирования напитков.
Из солей угольной кислоты применяют в медицине гидрокарбонат натрия (питьевая сода) для лечения ЖКТ как антоцидное средство и угольные таблетки – карболен в качестве адсорбента.
Цианиды натрия и калия растворяют золото и серебро, поэтому используются при добыче этих металлов.
Карбиды кальция применяются для получения метана и ацетилена:
СаО + 3С = СаС2 + СО, СаС2 + Н2О = СаО + С2Н2
Кремний по распространенности занимает второе место (после кислорода). На его долю приходится 26% от веса земной коры. В природе встречается в виде кремнезема (SiO2) – основная масса горных пород, кварца, песка и силикатов – производные кремневой кислоты – каолина (Al2O3·2SiO2·H2O), нефелина (NaAlSiO4).
Приведенные формулы являются лишь формулами состава силикатов и диоксида кремния. По структуре эти вещества представляют собой сложные полимерные молекулы, где атомы кремния соединены друг с другом и другими элементами через атомы кислорода (рис. 6).
| | | | |
-Si – Si –Si – Si – Si -
| | | | |
O O O O O
| | | | |
-Si-O-Si-O-Si-O-Si-O-Si-
| | | | |
Рис. 6. Полимерная структура (SiO2)n
Кремний образует два аллотропа: кристаллический (полупроводник) и аморфный. Кристаллический обладает металлическим блеском, но не металл.
В промышленности кремний получают путем восстановления кремнезема углеродом при высокой температуре:
SiO2 + 2C = Si + CO
В лаборатории - путем нагревания SiO2 с металлическим магнием:
SiO2 + 2Mg = Si + 2MgO
По числу валентных электронов кремний является аналогом углерода, однако у кремния больший размер атома, меньшая энергия ионизации, большее сродство к электрону и большая поляризуемость атома. Поэтому кремний по структуре и свойствам однотипных соединений существенно отличается от углерода. Макисмальное координационное число кремния равно 6, а наиболее характерное – 4. Как идля других элементов третьего периода, рπ - рπ – связывание для кремния не характерно и поэтому, в отличие от углерода, sp- sp2 – гибридные состояния для него неустойчивы. Кремний в соединениях имеет степень окисления +4, -4.
Кристаллический кремний – химически инертен, аморфный более реакционноспособный.
Он реагирует только с сильными окислителями и восстановителями. С фтором протекает реакция уже при обычных условиях, с кислородом и хлором при температуре 400-6000С. При очень высоких температурах соединяется с бромом, серой,, азотом и углеродом:
Si + 2Cl2 = SiCl4 Si + 2Br2 = SiBr4
Si + 2S = SiS2 3Si + 2N2 = Si3N4
Si + C = SiC Si + O2 = SiO2
Si + 2F2 = SiF4
С металлами образует силициды:
Si + Ca = Ca2Si
С кислотами не реагирует (исключение – плавиковая и азотная кислоты):
Si + 4HF = SiF4 + 2H2
Щелочи взаимодействуют с кремнием, окисляя его до солей кремневой кислоты:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Водородное соединение кремния - кремневодород (силан) получают действием соляной кислоты на силицид магния:
Mg2Si + 4HCl = 2MgCl2 + SiH4
Силан, подобно метану, горит с образованием диоксида кремния и паров воды:
SiH4 + 2O2 = SiO2 + 2H2O
При гидролизе силана образуется кремниевая кислота:
SiH4 + 3HOH = H2SiO3 + 4H2
Метан гидролизу не подвергается.
Кремний при избытке галогенов образуются комплексные соединения с координационным числом равным 6:
SiF4 + 2KF = K2[SiF6]
К кислородным соединениям кремния относятся диоксид кремния, кислоты, соли.
SiO2 – кремнезем, кварц – обычный песок, который входит в состав многих горных пород. Он белого цвета, не растворим в воде, обладает кислотными свойствами, реагирует при кипячении со щелочами с образованием солей – силикатов, нерастворимых в воде (растворяются только силикат натрия и калия):
SiO2 + 2NaOH = Na2SiO3
Силикаты подвергаются гидролизу по аниону, так как кремниевая кислота – очень слабая, двухосновная кислота. Представляет собой полимер (в чистом виде выделить не удалось). При попытке ее выделить подкисленным водным раствором ее солей она образует коллоидный раствор или золь, который существует очень малый промежуток времени. Золь быстро коагулирует и в виде геля осаждается. При высушивании геля образуются пористые структуры – силикагели. Они адсорбируют молекулы воды и других веществ, благодаря чему они применяются для очистки веществ от примесей:
2Na2SiO3 + H2O = 2NaOH + Na2Si2O5
Силикаты в большинстве нерастворимы в воде. Растворимы только силикаты натрия и калия.
Из кислот на диоксид кремния действует только плавиковая кислота:
SiO2 + 4HF = SiF4 + 2H2O
При сплавлении с карбонатами диоксид кремния вытесняет более летучий СО2:
SiO2 + Na2CO3 = Na2SiO3 + CO2
Кремниевую кислоту получают косвенным путем:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
При нагревании кремниевая кислота разлагается:
H2SiO3 → H2O + SiO2
Кремниевая кислота слабее угольной и поэтому последняя вытесняет H2SiO3 из водных растворов ее солей:
Na2SiO3 + H2O + CO2 = Na2CO3 + H2SiO3
Структура угольной кислоты и кремниевой различна:

 Н2СО3 НО - С = О OH
Н2СО3 НО - С = О OH
 OH Н2SiO3·H2O HO – Si - OH
OH Н2SiO3·H2O HO – Si - OH
OH
Кремниевая кислота представляет собой полимер, в котором атомы кремния соединены друг с другом через кислород.
Диоксиду кремния соответствуют кремниевые кислоты общей формулой mSiO2·nH2O. При n=1 метакремниевая кислота – H2SiO3; при n = 2 реализуется структура ортокремниевой кислоты – H4SiO4.
Соединения кремния участвуют в процессах роста волос и костей. Возникновение многих патологических процессов (атеросклероз, рак, туберкулез, зоб) связано с нарушением обмена в организме соединений кремния. При вдыхании пыли, содержащей соединения кремния, возникает силикоз.
Богатые кремнием сплавы применяются в технике в качестве кислотоупорного материала.
Жидкое стекло (силикат натрия и калия) применяется для изготовления огнеупорных замазок, цемента (глина и известняк: CaO, SiO2, Al2O3, Fe2O3), бетона, железобетона, для пропитки тканей с целью придания им огнестойкости, для укрепления грунтов при строительных работах. Стекло – это искусственный силикат (Na2O·CaO·6SiO2).
Германий, олово свинец – полные электронные аналоги. Как и у углерода и кремния, валентными являются s2p2-электроны. В ряду Ge → Sn → Pb уменьшается роль внешней s-электронной пары в образовании химической связи (участвуют уже не четыре, а только дваэлектрона). Так, если для Ge наиболее характерна степень окисления +4, то для свинца +2; в соединениях олова различие в степенях окисления проявляется менее резко, хоты производные олова (IV) более устойчивы. В ряду Ge → Sn → Pb усиливаются металлические свойства, восстановительные свойства и активность.
Водородные соединения получают косвенным путем:
Mg2Э + 4НCl = ЭН4 + 2MgCl2, где Э – Ge, Sn, Pb
Это газообразные вещества, неустойчивы. Устойчивость падает сверху вниз, то есть самый неустойчивый PbН4 – в свободном состоянии не существует.
Реагируют с галогенами по реакции:
Э + Г2 = ЭГ2
Э + 2Г2 = ЭГ4
Соединения со степенью окисления +2 – восстановители, со степенью окисления +4 – окислители. Галогениды подвергаются гидролизу по катиону (рН<7):
GeCl2 + HOH = H2GeO2 + HCl
SnCl2 + HOH = SnOHCl + HCl
GeCl4 + 2HOH = GeO2 + 4HCl
SnCl4 + 6HOH = H2[Sn(OH)6] + 4HCl
При взаимодействии оксидов и гидроксидов со щелочью образуются германиты, станнтиты, плюмбиты: Na2[Э(ОН)4]
Германий – рассеянный элемент, в земной коре 2·10-4% в виде минерала – германита. Получают из диоксида:
GeO2 + 2H2 = Ge + 2H2O
Это серебристо-белый твердый, хрупкий металл, на воздухе не изменяется, с водой не реагирует. Не растворяется в разбавленных кислотах, медленно растворяется в щелочах в присутствии окислителей:
Ge + 2NaOH + H2O2 = Na2GeO2 + 2H2O
С концентрированными кислотами выступает как восстановитель:
3Ge + 4HNO3 = 3GeO2 + 4NO + 2H2O
Ge + 2H2SO4 = GeO2 + 2SO2 + 2H2O
При температуре 200 0С реагирует с галогенами, серой, при температуре 700 0С кислородом:
Ge + S = GeS Ge + Cl2 = GeCl2 Ge + O2 = GeO2
GeO - черный порошок, не растворим в воде, сильный восстановитель, окисляется до GeO2, обладает амфотерными свойствами.
Гидроксиды получают косвенным путем:
GeCl2 + 2NaOH = 2NaCl + Ge(OH)2↓
GeO2 - белый кристаллический порошок, не растворим в воде, амфотерен c преобладанием кислотных свойств. Гидроксид германия со степнью окисления +4 называют германиевой кислотой – Н2GeO3:
3Ge + 4HNO3(конц) + H2O = 4NO + 3H2GeO3
Соединения германия применяют в производстве оптических стекол и полупроводников.
Олово рассеянный элемент, в земной коре 6·10-4%, в виде оловянного камня (SnO2). Получают по реакции:
SnO2 + 2C = Sn + 2CO
Это серебристо-белый мягкий металл, пластичен, коррозионно стоек. Существует в виде аллотропных модификаций (белое олово, серое олово).
При обычных условиях не реагирует с кислородом, водой, разбавленных кислотах, аммиаком.
При комнатной температуре с концентрированными кислотами:
Sn + 2HCl = SnCl2 + H2
3Sn + 4HNO3 + H2O = 3H2SnO3 + 4NO
При нагревании:
Sn + 4H2SO4 = Sn(SO4)2 + SO2 + 4H2O
SnO – черного цвета, не растворим в воде, гидроксид получается косвенным путем, обладают амфотерными свойствами, восстановители:
Sn(OH)2 + 2NaOH = Na2SnO2 + 2H2O
станнит натрия
Sn(OH)2 + 2HCl = SnCl2 + 2H2O
SnCl2 + HgCl2 = Hg + SnCl4
SnCl2 + 2FeCl3 = SnCl4 + 2FeCl2
Sn2+ -2e = Sn4+ восстановитель, процесс окисления
SnO2 – белого цвета, не растворим в воде, гидроксид получают косвенным путем, амфотерные свойства с преобладанием кислотных, окислитель.
Гидроксиды олова (IV) называются оловянными кислотами. Известно две их модификации: α-оловянная кислота и β– оловянная кислота.
α-оловянная кислота может быть получена действием водного раствора аммиака на раствор хлорида олова (IV):
SnCl4 + 4NH4OH = H2SnO3 + 4NH4Cl + H2O
Выпадающий белый осадок при высушивании постепенно теряет воду, превращаясь в диоксид олова. Таким образом, кислоты определенного состава получить не удается. Правильнее бы изобразить состав кислоты формулой mSnO2·nH2O
α-оловянная кислота легко растворяется в щелочах, образуя гидроксостаннаты:
H2SnO3 + 2NaOH + H2O = Na2[Sn(OH)6]
Кислоты также растворяют α-оловянную кислоту с образованиием солей олова (IV):
H2SnO3 + 4HCl = SnCl4 + 3H2O
При избытке соляной кислоты хлорид олова (IV) присоединяет две молекулы хлороводорода, образуя комплексную гексахлорооловянную (оловохлористоводородную) кислоту – H2[SnCl6].
β– оловянная кислота получается действием концентрированной азотной кислоты на олово. В отличие от α-оловянной кислоты, она не растворяется ни в кислотах, ни в растворах щелочей. Но путем сплавления со щелочами можно перевести ее в раствор в виде станната.
α-оловянная кислота при хранении ее в соприкосновении с раствором, из которого она выделилась, тостепенно тоже превращается в β– оловянную кислоту.
Соли четырехзарядных элементов подвергаются гидролизу по катиону:
SnCl4 + 3HOH = H2SnO3 + 4HCl
Олово применяется для лужения железа, для пайки металлов, в сплавах (бронза – медь и олово). Окись олова используется для получения рубинового стекла, двуокись – для изготовления глазурей и эмалей. SnS – нерастворимый в воде, золотисто-желого цвета под названием «сусальное золото» используется для «золочения» деревянных, гипсовых и других изделий.
Свинец в земной коре содержится 1,6·10-3% в виде свинцового блеска (PbS) и свинцовой руды (PbO). Получают путем реакций:
2PbS + 3O2 = 3PbO + 2SO2
PbO + C = Pb + CO
Это голубовато-белый металл, мягкий, тяжелый, пластичен, при очень низких температурах проводит электрический ток.
При обычной температуре в сухом воздухе свинец покрывается оксидной пленкой (PbO), которая предохраняет от коррозии (окисления) и действия воды. Окисление происходит только при большой температуре.
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 588; Нарушение авторских прав?; Мы поможем в написании вашей работы!