
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Полный кинетический анализ процесса
|
|
|
|
Для обеспечения высокой скорости и селективности процесса обычно применяют катализаторы. При пиролизе пропана применяют синтетические керамические катализаторы. Механизм описывается следующими стадиями:
Термический распад пропана на этилен и метан.
На стадии инициирования возможно протекание следующих реакций:
С3Н8→∙Н + ∙С3Н7 (1)
lg k0=16,0 c-1; Ea=410 кДж/моль
С3Н8→СН3∙ + ∙С2Н5 (2)
lg k0=17.6 c-1; Ea=342 кДж/моль
(1) и (2) реакции являются сопряженными, следовательно отношение их констант К2/К1=EXP(Ea1+Ea2)*1000/RT

С увеличением температуры снижается влияние различия в энергиях активации реакций на избирательность процесса.Однако, даже при 1800К –температура намного выше реальной температуры пиролиза пропана К2›К1. Таким образом, для стадии инициирования пропана имеет значение только реакция распада его на метильный и этильный радикалы.
Так как реакция (2) является элементарной, к ней приложим закон действующих масс и зависимости от температуры описываются уравнением 1-го порядка.
-dC(пропан) /dt=-k01∙C(пропан) , интегрируя получаем: С (пропан)=C(пропан)0 ∙exp(-k01∙t)
Степень конверсии рассчитывается следующим образом
Х=(C(пропан)0- С (пропан))/ C(пропан)0*100, %

Показывает степень превращения пропана (%) по реакции (01) при температурах соответственно 973К((1), 983К (2), 988К (3),993К и 1023К (5). Причем с повышением температуры происходит увеличение степени конверсии пропана, таким образом при температуре 1023К практически пропан полностью прореагировал.
I. Стадия инициирования по избранному процессу.

lgk01=17.6 c-1
Ea=342 кДж/моль образование метильного и пропильного радикалов
II. Развитие цепи.
1. При пониженной температуре.
Взаимодействие с метильным радикалом, при этом получается метан и пропильный радикал по вторичному атому:

lgk03=8,9 с-1
Еа=42,3 кДж/моль
ЕСперв-Н > ЕСвтор-Н, поэтому процесс образования радикала идет по вторичному атому.
При взаимодействие с этильным радикалом образуется этан

lgk04=8,9 с-1
Еа=43,3 кДж/моль
2. При повышенной температуре.

lgk=9,0с-1
Еа=48.1 кДж/моль

lgk=9,1 c-1
Ea=52,7 кДж/моль
III. Распад радикала.
1. При пониженных температурах пропильный радикал распадается на водород и пропилен.

lgk= 13,6c-1
Еа= 168,6 кДж/моль
При взаимодействии пропана с водородным радикалом образуеться водород и пропильный радикал.
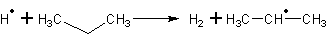
lgk=11,0 c-1
Ea=34,7 кДж/моль
Реакция (3) и (4) образуют звено цепи.
Таким образом, на этой стадии процесс идет со следующим превращением.
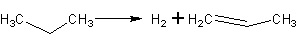
2. При повышенных температурах:
Пропильный радикал по первичному атому распадается
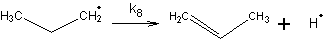
lgk08=13,6 с-1
Еа=168,6 кДж/моль
Происходит образование радикалов пропана по первичному атому
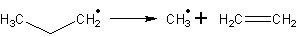
lgk=13,2 c-1
Ea=133,9 кДж/моль
Ec-н > Ec-с, поэтому при повышенных температурах произойдет разрыв по
с-н связи.
Метильный радикал взаимодействует с пропаном.

lgk=9,0 c-1
Ea=48,1 кДж/моль

Следовательно, процесс нужно проводить при повышенных температурах так как в этих условиях получается этилен.
Важным фактором, влияющим на селективность пиролиза, является давление в зоне реакции, точнее – парциальное давление углеводородной части реагирующего потока. Этилен и другие низшие олефины образуются в результате первичных реакций первого кинетического порядка, степень превращения сырья по этим реакциям от давления не зависит, но олефины реагируют дальше, превращаясь в продукты полимеризации или конденсации и степень их превращения по этим направлениям пропорциональна парциальному давлению. Парциальное давление углеводородной части реагирующей смеси определяется суммарным давлением в реакторе и разбавлением сырья водяным паром.
Три важнейших параметра пиролиза – температура, время пребывания и парциальное давление углеводородов – для оценки выходов продуктов и выбора оптимальных условий пиролиза.
|
|
|
|
|
Дата добавления: 2015-06-26; Просмотров: 1357; Нарушение авторских прав?; Мы поможем в написании вашей работы!