
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химических реакций. Факторы, влияющие на скорость химических реакций
|
|
|
|
Понятие об энтропии и изобарно-изотермическом потенциале. Максимальная работа процесса. Роль энтальпийного и энтропийного факторов в направленности процессов при различных условиях.
Принцип химического взаимодействия (1850). За меру можно взять тепловой эффект реакции: если теплота выделяется – то реакция возможна, т.е. будет идти в прямом направлении. Потом было выяснено, что могут идти самопроизвольно и эндотермические реакции. S (энтропия) – количественная мера беспорядка в системе. S увеличивается при переходе жидкости в пар, при растворении кристаллического в-ва, уменьшается – при конденсации, при кристаллизации.
Энтропия ↑ - при переходе жидкости в пар, при растворении кристаллического вещества; ↓ при конденсации. В химических процессах одновременно действуют 2 тенденции: 1-стремление частично объединиться за счет прочности связей в более сложные, что ↓ энтропийные системы. 2—стремление частично разъединиться, что ↑ энтропию. Суммарный процесс, протекающий при постоянных Т и р, отражается изменением энергии Гиббса. Δ G (энергия Гиббса) = ΔН (энтальпия) - Т·ΔS
Характер изменения энергии Гиббса позволяет судить о возможности или невозможности осуществления процесса.
1) ΔН≈0, то Δ G=-Т·ΔS, т.е.<0 –реакция возможна.
2) ΔН<0, то Δ G=<0 –реакция возможна. – экзотермическая.
3) ΔН>0, то Δ G=>0 –реакция невозможна. – эндотермическая.
Если Δ G=0 – система находится в состоянии химического равновесия.
Н-Энтальпия (теплота образования) – теплота, которая выделяется или поглощается при образовании 1 моль сложного в-ва из молекул простого в-ва.
ΔН0=∑ΔН0обр.кон.в-ва --∑ΔН0обр.исх.в-ва.
Аmaх=--ΔF –наибольшая работа, которую может дать химическая реакции, осуществляемая в условиях полной обратимости.
Изотермический процесс протекает при постоянной температуре.
Изобарный – при постоянном объеме.
Химическая кинетика – наука о скоростях химических реакций.
Скорость гомогенной химической реакции определяется количеством вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени в единице объема
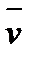
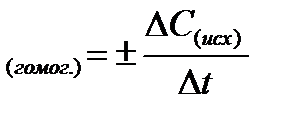 Δt = t2 – t1 ΔC = С2 – С1
Δt = t2 – t1 ΔC = С2 – С1
Скорость гетерогенной химической реакции определяется количеством вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени на единице поверхности раздела фаз: 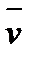
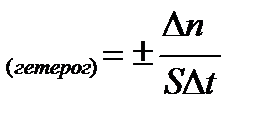 ; [
; [ 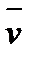 ] =
] = 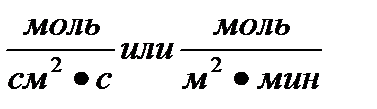
| Фактор | Направление смещения равновесия |
| Повышение концентрации исходного вещества | В сторону прямой реакции (вправо) |
| Понижение концентрации продукта реакции (вывод продукта из сферы реакции) | В сторону прямой реакции (вправо) |
| Понижение концентрации исходного вещества | В сторону обратной реакции (влево) |
| Повышение концентрации продукта | В сторону обратной реакции (влево) |
| Повышение давления ≡ уменьшение объема системы | В сторону меньшего числа молей газообразных веществ |
| Понижение давления ≡ увеличение объема системы | В сторону большего числа молей газообразных веществ |
| Повышение температуры | В сторону эндотермической реакции |
| Понижение температуры | В сторону экзотермической реакции |
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 534; Нарушение авторских прав?; Мы поможем в написании вашей работы!