
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спектральные методы анализа(спектрометрия, спектроскопия, спектрофотометрия. Закон Бугера-Ламберта-Бера
|
|
|
|
Общая характеристика разбавленных растворов неэлектролитов. Свойства растворов (давление насыщенного пара над раствором, эбуллиоскопия и криоскопия, осмос). Роль осмоса в биологических процессах.
Растворы неэлектролитов—раствор, не проводящие электрический ток.
Давление насыщенного пара над раствором. При данной температуре давление насыщенно пара над каждой жидкостью—величина постоянная. При растворении в жидкости какого-либо вещества давление насыщенною пара этой жидкости понижается. Таким образом, давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре. Разность между этими величинами принято называть понижением давления пара над раствором (или понижением давления пара раствора). Отношение величины этого понижения к давлению насыщенного пара над чистым растворителем называется относительным понижением давления пара над раствором.
Раулем было установлено, что давление насыщенного пара над раствором равно его давлению над чистым растворителем, умноженному на мольную долю растворителя в растворе, где р0 -давление насыщенного пара над чистым растворителем, р -давление насыщенного пара над раствором, п0 -грамм-моль растворителя, п -число грамм-моль растворенного вещества. р0 - р/р0 = п/п+п0 –это уравнение получило название первого закона Рауля, оно читается так: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе. Растворы, которые строго подчиняются закону Рауля наз. Идеальными.
Криоскопия – это понижение температуры и замерзание раствора. ΔТзамерз = К· т,
К—это криоскопическая константа, т —молярная концентрация (моляльность), где К=ΔТзамерз; К (криоскопическая постоянная) показывает температуру замерзания, вызываемую растворением одного моля вещества в 1000г этого раствора.
Эбуллиоскопия или криоскопическая константа кипения – характерна для данного растворителя и показывает на сколько градусов повышается температура кипения при растворении одного моля неэлектролита в 1000г растворителя. ΔТкипен = Е· т. Е (эбуллиоскопическая постоянная) зависит только от природы растворителя, но не зависит от природы растворенного вещества.На измерениях температур кипения и замерзания растворов основаны эбуллиоскопический и криоскопический методы определения молекулярных масс веществ. Оба методы широко используются в химии, так как, применяя различные растворители, можно определять молекулярные массы разнообразных веществ.
Осмос – проникновение молекул растворителячерез полупроницаемую мембрану. Осмос проявляется в системе состоящей из раствора и растворителя, отделенного друг от друга полупроницаемую мембрану. Осмос проявляется в системе состоящей из раствора и растворителя, отделенного друг от друга полупроницаемой мембраной, или два раствора разной концентрацией отделенной друг от друга мембраной.
Осмотическое давление—это давление, которое можно применить к раствору, чтобы он находился в равновесии с растворителем, отделенным от него полупроницаемой мембраной. Типы полупроницаемых мембран: ткани растений и животных. Искусственно полученные мембраны. Химические.Растворы обладают при одинаковых условиях одинаковым осмотическим давлением, получил название изотонического. Раствор, концентрация которого ниже концентрации клеточного сока, клетка всасывает воду, что объяснятся более низким, чем в клетки осмотическим давлением раствора-гипотонические растворы. Гипертонический раствор обратен гипотоническому.
Осмос играет очень большую роль в биологических процессах, благодаря ему может осуществляться транспорт веществ в клетку и из нее.
44. Дисперсные системы, их классификация. Коллоидные растворы и их основные свойства: кинетические, оптические, электрические. Строение коллоидных частиц. Значение коллоидов в биологии.
Дисперсные системы, образования из двух или большего числа фаз (тел) с сильно развитой поверхностью раздела между ними. В Д. с. по крайней мере одна из фаз — дисперсная фаза — распределена в виде мелких частиц (кристалликов, нитей, плёнок или пластинок, капель, пузырьков) в другой, сплошной, фазе — дисперсионной среде. Д. с. по основной характеристике — размерам частиц или (что то же самое) дисперсности (определяемой отношением общей площади межфазной поверхности к объёму дисперсной фазы) — делятся на грубо (низко) дисперсные и тонко (высоко) дисперсные, или коллоидные системы (коллоиды). В грубодисперсных системах частицы имеют размер от 10-4 см и выше, в коллоидных — от 10-4—10-5 до 10-7 см. По агрегатному состоянию дисперсионной среды различают газодисперсные системы — аэрозоли (туманы, дымы), пыль; ж идкодисперсные — золи, суспензии, эмульсии, пены ; твёрдодисперсные — стеклообразные или кристаллические тела с включениями мельчайших твёрдых частиц, капель жидкости или пузырьков газа. Пыль, суспензии, лиофобные эмульсии — грубодисперсные системы; как правило (при наличии разности плотностей), они седиментационно неустойчивы, т. е. их частицы оседают под действием силы тяжести или всплывают. Золи — типичные высокодисперсные коллоидные системы, частицы дисперсной фазы которых (мицеллы) участвуют в броуновском движении. Д. с. могут быть бесструктурными( свободнодисперсными) и структурированными (связнодисперсными). Характерная особенность Д. с. — высокая свободная энергия как следствие сильно развитой межфазной поверхности; поэтому Д. с. обычно (кроме лиофильных Д. с.) термодинамически неустойчивы. Они обладают повышенной адсорбционной способностью, химической, а иногда и биологической активностью. Д. с. широко распространены в природе, технике и быту. Примерами Д. с. могут служить горные породы, грунты, почвы, дымы, облака, атмосферные осадки, растительные и животные ткани; строительные материалы, краски, моющие средства, волокнистые изделия, важнейшие пищевые продукты и многие др.
Коллоидные растворы - это высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы, причем линейные размеры частиц последней лежат в пределах от 1 до 100 нм. Коллоидные растворы по размерам частиц являются промежуточными между истинными растворами и суспензиями и эмульсиями. Коллоидные частицы обычно состоят из большого числа молекул или ионов.
Коллоидные растворы иначе называют золями.
Одним из важных свойств золей является то, что их частицы имеют электрические заряды одного знака. Благодаря этому они не соединяются в более крупные частицы и не осаждаются. Возникновение заряда объясняется адсорбцией коллоидными частицами ионов из раствора.Для осаждения золя необходимо, чтобы его частицы соединились в более крупные агрегаты. Соединение частиц в более крупные агрегаты называется коагуляцией, а осаждение их под влиянием силы тяжести - седиментацией.
Обычно коагуляция происходит при прибавлении к золю: 1) электролита, 2) другого золя, частицы которого имеют противоположный заряд, и 3) при нагревании.
Молекулярно-кинетическими называют те свойства, которые связаны с хаотическим тепловым движением частиц, образующих те или иные системы. Различия в молекулярно-кинетическом поведении молекулярно-, коллоидно-, и микроскопически-дисперсных систем зависят от размеров частиц, образующих эти системы, и носят количественный характер.
К молекулярно-кинетическим свойствам дисперсных систем относятся броуновское движение, диффузия и седиментация.
Диффузия – самопроизвольное выравнивание концентрированных коллоидных частиц в объеме жидкости или газа под воздействием броуновского движения.
Броуновским движением называется беспорядочное, хаотичное—подобное рою комаров, пляшущих в солнечном луче,— движение коллоидно- и микроскопически-дисперсных частиц.
Седиментацией называют свободное оседание частиц в вязкой среде под действием гравитационного поля. Скорость оседания прямо пропорциональна ускорению гравитационного поля Земли (g), разности плотностей частиц и окружающей среды, квадрату радиуса оседающих сферических частиц и обратно пропорциональна вязкости среды (закон Стокса, 1880 г.).
СТРОЕНИЕ КОЛЛОИДНЫХ ЧАСТИЦ
Коллоидные частицы имеют сложное строение. Они состоят из ядер и адсорбированных и притянутых ионов. Рассмотрим строение коллоидной частицы кремниевой кислоты, которая образовалась в результате взаимодействия очень разбавленных растворов силиката натрия и соляной кислоты (Na2Si03 + 2HCl = H2Si03 + 2NaCl). Если Na2Si03 находится в избытке, то кремниевая кислота не выпадает в осадок, а образуется прозрачный коллоидный раствор H2Si03. Ядро коллоидной частицы нейтрально, оно состоит из m молекул H2Si03. На поверхности ядра адсорбируются n ионов Si032-, это потенциалопределяющие ионы, так как они обуславливают заряд частицы коллоидного раствора.
Адсорбированные потенциалопределяющие ионы притягивают из раствора ионы противоположного знака — противоионы. В данном случае это ионы Na+, причем часть их 2(n - х) адсорбируется на частице. Адсорбированные ионы Si032- вместе с противоионами Na+ образуют адсорбционный слой. Другая часть противоионов 2xNa+ находится в жидкой фазе и образует подвижный диффузный слой.
Ядро вместе с адсорбционным слоем называется гранулой.
В нашем примере гранула заряжена отрицательно, так как адсорбция ионов Si032- происходит сильнее, чем ионов Na-.
Коллоидная частица вместе с противоионами диффузионного слоя называется мицеллой. Это отдельная частица коллоидного раствора.
Мицелла (коллоидная частица)

45.Сущность и виды титриметрических определений: прямое, обратное и косвенное. Способы выражения концентрации растворенных веществ.
Качественный анализ – идентифицирование объектов, путем обнаружения аналитического сигнала (образование осадка, изменение окраски, окрашивание пламени и т.д.). Задача количественного анализа – определение содержание компонентов (c, w) путем измерения величины или интенсивности аналитического сигнала.
Химические методы количественного анализа:
- гравиметрический (измерение массы «весовой»);
- титриметрический (измерение объемов «объемный») – имеет ряд преимуществ – скорость выполнения определений, относительную несложность операций, достаточную точность получаемых результатов. В анализе измеряют объемы, как определяемого вещества, так и реагента, который применяется при данном определении.
Требования к реакции:
- момент окончания реакции (точка эквивалентности) должна четко и хорошо определяться (изменение окраски, физико-химических показателей);
- постоянная равновесия проводимой титриметрической реакции должна быть достаточно велика, а константа обратной реакции по возможности мала;
- скорость аналитической реакции должна быть достаточно велика, чтобы имелась возможность точно фиксировать точку эквивалентности;
- не должно быть побочных реакций;
- вещества, мешающие определению точки эквивалентности и протеканию основной реакции, должны отсутствовать.
Виды:
- прямое титрование – определяемый ион непосредственно титруют раствором реагента или наоборот;
- обратное титрование – к анализирующему раствору приливают некоторый избыток реагента и этот избыток оттитровывают другим реагентом (роданометрия);
- способ замещения (косвенный) – определяемый ион не взаимодействует непосредственно с рабочим раствором, или реагирует с ним в нестехиометрических соотношениях, или не дает реакции с индикатором (метод иодометрии).
Способы выражения концентрации растворенных веществ в титровании:
Под растворимостью понимают концентрацию насыщенного раствора данного вещества при определенной температуре.
- титром раствора называют количество граммов растворенного вещества, содержащееся в 1 мл раствора; его обозначают так:THCL=0,03604. Это означает, что каждый миллилитр этого раствора соляной кислоты содержит 0,03604 г HCL. T= m/v.
- молярная концентрация – это химическое количество растворенного вещества, содержащегося в 1литре его насыщенного раствора (S): S=n/V моль/дм3
- молярная концентрация эквивалента – нормальность показывает число эквивалентов растворенного вещества в 1 литре раствора. Нормальность – Cm, М.Р.В. Для V=1 литр: Cm=м.р.в/Э. Нормальную концентрацию обозначают также через N для любого V, выраженного в мл. Cm=м.р.в. • 1000/ЭV
46+47.Классификация методов титриметрического титрования. Виды кривых титрования. Индикаторы в титриметрии.
Классификация методов титриметрического титрования:
- кислотно- основное титрование (нейтрализации): H+ + OH- →H2O и H3O +OH- →2H2O. Точка эквивалентности определяется при помощи индикаторов, которые меняют окраску в зависимости от реакции среды (определяются концентрации кислот, щелочей и солей, гидролизующихся в водных растворах);
- окислительно–восстановительное (редоксиметрия) – основана на ОВР, которые протекают между рабочим раствором и определяемым веществом. Примеры:
1. перманганатометрия – рабочий раствор KMnO4 - окислитель, при помощи которого определяют Fe2+, NO2-,CNS- и др.
2. иодометрия – окислитель I2, а в виде восстановителя I-. Этим способом определяется KMnO4, MnO2, CL2, Na2SO3;
3. хроматометрия – в виде окислителя применяют рабочий раствор бихромата калия K2Cr2O7.
4. броматометрия – рабочий раствор окислителя - бромат калия KBrO3.
5. ванадатометрия – рабочий раствор ванадат аммония NH4VO3.
6. цериметрия – окислителем и рабочим раствором являются различные соединения церия Ce (IV).
- метод осаждения – основан на реакциях обмена, при которых определяемый элемент (ион) переходит в осадок. В зависимости от того, какой реагент используют в качестве рабочего раствора, метод получает соответствующие названия. Если используют раствор нитрата серебра, то способ называют аргентометрия, если раствор роданида аммония NH4CNS – роданометрия, при применении раствора соли ртути (I) – меркурометрией и т.д.
- комплексонометрия (хелатометрия) с участием органических лигандов (комплексонов). Комплексон – двунатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА), известная под торговым названием трилон Б (комплексон III)
- комплексиметрическое
Виды кривых титрования:
Это графическое отображение зависимости изменения pH раствора от V прибавляемого титранта.
1. Линейная
2. Логарифмическая.
Чтобы построить кривую титрования нужно рассчитать значение pH в следующих точках:
- до начала титрования;
- до точки стехиометричности;
- в точке стехиометричности;
- после точки стехиометричности.
Особенно тщательно рассматривают рН вблизи точки стехиометричности, для того чтобы правильно определить величину скачка титрования – область резкого изменения значения pH вблизи точки стехиометричности. Анализ позволяет правильно подобрать индикатор. Интервал перехода индикатора должен находиться в пределах скачка титрования на кривой.
Виды:
1. Титрование сильной одноосновной кислоты с сильным основанием.
HCL + NaOH = NaCl + H2O
1. до начала титрования pH определяется концентрацией кислоты pH<7
2. до точки стехиометричности кислота в избытке pH – концентрация кислоты
3. в точке стехиометричности есть не гидролизированная соль NaCl и H2O (pH – автопротолизом H2O, pH=7).
4. после ТС pH определяется избытком щелочи pH>7.
2. Титрование слабой кислоты и сильного основания.
1. до начала титрования определяется СCH3COOH и ее pK
2. до ТС – определяется буферной смесью
pH CH3COOH + NaOH = CH3COONa + H2O
3. в ТС pH определяется гидролизир. Солью
4. после ТС pH определяется избытком щелочи.
3. Титрование многоосновных кислот и оснований.
Многоосновные кислоты диссоциируют ступенчато, соответственно каждой ступени соответствует своя Ku, т.к. они являются как правило слабыми электролитами. Поэтому при титровании на кривой должно быть несколько скачков, каждой из которых соответствует ступени нейтрализации. Например, H3PO4 – диссоциирует трехступенчато и фактически мы титруем смесь трех кислот.
H3PO4 ↔ H2PO4- + H+
H2PO4- ↔ HPO42- + H+
HPO42- ↔ PO43- + H+
HPO42- является очень слабой кислотой и оттитровать ее практически невозможно, кроме того диссоциация HPO42- практически полностью подавляется гидролизом PO43-, из-за этих двух причин на кривой присутствует только два скачка.
Кислотно-основные индикаторы – это вещества, изменяющие свою окраску при достижении определенного значения pH раствора. Требования к индикатором:
- окраска индикатора должна быть интенсивной и различной в кислых и щелочных средах;
- изменение окраски должно быть четким, быстрым и обратным;
- индикатор должен быть чувствительным;
- должен быть стабильным и не разлагаться в растворе.
У бесцветных индикаторов изменение окраски связано с введением хромофорных групп (─N═N─, ─N═O, ─NO2, ═C═C═ и другие). А у двухцветных вследствие перехода одних хромофорных групп в другие появляются ауксохромные группы (OH, NH2, NHR, NR2).
Фенолфталеин
кислотно-основной индикатор (интервал перехода окраски при рН 8,2-9,8). При растворении Ф. в разбавленных растворах щелочей он приобретает пурпурный цвет (соединение II) и обесцвечивается при прибавлении кислоты, а также в сильно щелочном растворе (соединение III):
Метиловый оранжевый
Гелиантин
натрия 4-(4-диметиламинофенилазо) бензолсульфонат
Метиленовый синий
N,N,N',N' - тетраметилтионина хлорид тригидрат
метиленовая синь
метиленовый голубой.
Спектроскопия-раздел физики, посвященный изучению спектров электромагнитного излучения.
Спектральный анализ, физический метод качественного и количественного определения атомного и молекулярного состава вещества, основанный на исследовании его спектров. Физическая основа С. а.— спектроскопия атомов и молекул, его классифицируют по целям анализа и типам спектров. Атомный С. а. (АСА) определяет элементный состав образца по атомным (ионным) спектрам испускания и поглощения, молекулярный С. а. (МСА) — молекулярный состав веществ по молекулярным спектрам поглощения, люминесценции и комбинационного рассеяния света.
Эмиссионный С. а. производят по спектрам испускания атомов, ионов и молекул, возбуждённым различными источниками электромагнитного излучения в диапазоне от g-излучения до микроволнового.
Абсорбционный С. а. осуществляют по спектрам поглощения электромагнитного излучения анализируемыми объектами (атомами, молекулами, ионами вещества, находящегося в различных агрегатных состояниях).
Количественный АСА осуществляют сравнением интенсивностей двух спектральных линий в спектре пробы, одна из которых принадлежит определяемому элементу, а другая (линия сравнения) — основному элементу пробы, концентрация которого известна, или специально вводимому в известной концентрации элементу («внутреннему стандарту»). В основе количественного АСА лежит соотношение, связывающее концентрацию с определяемого элемента с отношением интенсивностей линии определяемой примеси (I1) и линии сравнения (I2):
I1/I2 = acb
(постоянные а и b определяются опытным путём), или
lg(I1/I2) = b lgс + lga.
Спектрофотометр - спектральный прибор, который осуществляет фотометрирование — сравнение измеряемого потока с эталонным (референтным) для непрерывного или дискретного ряда длин волн излучения. С. обеспечивает отсчёт или автоматическую регистрацию результатов сравнения в соответствующей двумерной шкале: абсцисса — длина волны, ордината — результат фотометрирования на этой длине волны. С. также называют аналитические приборы, которые не измеряют спектров, а определяют концентрации элементов в пробе по линиям абсорбции (или эмиссии) атомов в пламени (атомно-абсорбционные или пламенные С.) или определяют концентрации компонент в смесях веществ по характеристическим полосам поглощения (например, двуволновые инфракрасные С. или С.-анализаторы).
Бугера —Ламберта — Бера закон, определяет постепенное ослабление параллельного монохроматического (одноцветного) пучка света при распространении его в поглощающем веществе. Если мощность пучка, вошедшего в слой вещества толщиной l, равна Io, то, согласно Б.—Л.—Б. з., мощность пучка при выходе из слоя.
Атом, ион или молекула, поглощая кплпт спета, переходит в более высокое энергетическое состояние. Обычно это бывает переход с основного, невозбужденного уроппя на одни из более высоких, чаще всего на мерный возбужденный уровень. Вследствие поглощения излучения при прохождении его через слой вещества интенсивность излучения уменьшается и тем больше, чем выше концентрация светоногдощаюшего вещества.
Закон Бугера - Ламберта Вера связывает уменьшение интенсивности света, прошедшего через слой еветопоглощлющего вещества, с концентрацией вещества и толщиной слоя. Чтобы учесть потери света на отражение и рассеяние, сравнивают интенсивности света, прошедшего через исследуемый раствор и растворитель. При одинаковой толщине слоя в кюветах из одинакового материала, содержащих один и тот же раство-
Закон выражается следующей формулой:
А=ε·l·c, А оптическая плотность, l — толщина слоя вещества, через которое проходит свет, с — концентрация раствора.
ε - показатель поглощения — коэффициент, характеризующий свойства вещества и зависящий от длины волны λ поглощаемого света. Эта зависимость называется спектром поглощения вещества.
49. ИК–спектроскопия в определении орг. веществ. Представление об атомно-абсорбционном эмиссионном спектральном анализе, рентгеноструктурном анализе.
ИК–спектроскопия позволяет: идентифицировать органические вещества; исследовать природу органических связей; функциональные группы; пространственное строение молекул; изучить молекулярную структуру полимеров; определить чистоту компонентов в орг. синтезе.
Спектры ИК часто интерпретируются на основе привлечения некоторых эмпирических закономерностей. При такой интерпретации спектров молекул важнейшим понятием оказывается понятие характеристичности колебаний. Энергия характеристического колебания сосредоточена в основном на одной определенной связи, так что ковалентную связь некоторых атомов А-В в молекуле можно рассматривать как некоторую независимую молекулу и ее частоту рассчитать по уравнению, не учитывая того, что и другие атомы входят в молекулу, а энергия колебаний обусловлена другими, кроме А и В, атомами. Характеристическими являются колебания с участием атомов водорода и дейтерия, а также с участием группировок, содержащих двойные и тройные связи - OH, NH, SH, CH, C=C, C=O, C=N, C=C=O, N=O, S=O, P=O и др. Наборы частот характеристических колебаний сведены в корреляционные таблицы. Колебания подразделяются на валентные, при которых преимущественно изменяются длины связей, и деформационные, при которых наибольшее изменение характерно для величин валентных углов. Валентные колебания подразделяется на симметричные и асимметричные, а деформационные на крутильные, ножничные, маятниковые и др.
Важнейшими характеристиками полосы поглощения являются следующие:
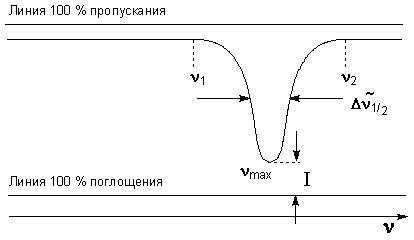
1) частота колебания (более точно - волновое число) в максимуме поглощения νmax;
2) пиковая интенсивность в максимуме поглощения и связанные с ней величины - оптическая плотность D и кажущийся коэффициент экстинкции ε;
3) ширина полос поглощения (иногда называют полушириной) ширина полосы, выраженная в см-1 на середине ее высоты, когда последняя выражена в единицах относительной плотности, т.е. когда D = 0,5·Dmax
Абсорбционная спектроскопия, изучает спектры поглощения электромагн. излучения атомами и молекулами в-ва в разл. агрегатных состояниях. Интенсивность светового потока при его прохождении через исследуемую среду уменьшается вследствие превращения энергии излучения в разл. формы внутр. энергии в-ва и (или) в энергию вторичного излучения. Поглощат. способность в-ва зависит гл. обр. от электронного строения атомов и молекул, а также от длины волны и поляризации падающего света, толщины слоя, концентрации в-ва, т-ры, наличия электрич. и магн. полей. Для измерения поглощат. способности используют спектрофотометры-оптич. приборы, состоящие из источника света, камеры для образцов, монохроматора (призма или дифракционная решетка) и детектора. Сигнал от детектора регистрируется в виде непрерывной кривой (спектра поглощения) или в виде таблиц, если спектрофотометр имеет встроенную ЭВМ.
Широко применяют для изучения строения в-ва. Она особенно эффективна при исследовании процессов в жидких средах; по изменениям положения, интенсивности и формы полос поглощения судят об изменениях состава и строения поглощающих свет частиц без их выделения из р-ров.
Рентгеновская спектроскопия, раздел спектроскопии, изучающий спектры испускания (эмиссионные) и поглощения (абсорбционные) рентгеновского излучения, т.е. электромагн. излучения в области длин волн 10-2-102 нм. Р. с. используют для изучения природы хим. связей и количеств. анализа в-в (рентгеновский спектральный анализ). С помощью Р. с. можно исследовать все элементы (начиная с Li) в соед., находящихся в любом агрегатном состоянии.
Рентгеновские спектры обусловлены переходами электронов внутр. оболочек атомов. Различают тормозное и характеристич. рентгеновское излучение. Первое возникает при торможении заряженных частиц (электронов), бомбардирующих мишень в рентгеновских трубках, и имеет сплошной спектр. Характеристич. излучение испускают атомы мишени при столкновении с электронами (первичное излучение) или с рентгеновскими фотонами (вторичное, или флуоресцентное, излучение). В результате этих столкновений с одной из внутр. оболочек атома вылетает электрон и образуется вакансия, к-рую заполняет электрон с другой (внутр. или внеш.) оболочки. При этом атом испускает квант рентгеновского излучения.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 2021; Нарушение авторских прав?; Мы поможем в написании вашей работы!