
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
От В до Ne
|
|
|
|
Li
Не
Н
Что же при таких представлениях у нас получится с водородом? У основного состояния водорода l=m= 0и n =1; мы говорим, что у него электронная конфигурация 1 s. Энергия равна -13,6 эв. Это значит, что для отрыва электрона от атома нужно 13,6 эв энергии. Ее называют «энергией ионизации», W 1. Большая энергия ионизации означает, что оторвать электрон трудно, но водород может отнять электрон у другого атома, а потому он химически активен.
Теперь обратимся к гелию. Оба электрона в гелии могут находиться в одном и том же нижнем состоянии (только у одного спин направлен вверх, у другого — вниз). В своем наинизшем состоянии электрон движется в поле с потенциалом, который при малых r походит на кулонов потенциал с Z=2, а при больших r — на кулонов потенциал с Z=1. В результате возникает «водородоподобное» 1 s -состояние с несколько более низкой энергией. Оба электрона занимают одни и те же 1s-состояния (l =0, m =0). Наблюдаемая энергия ионизации (требуемая на отрыв одного электрона) равна 24,6 эв. Поскольку теперь «оболочка» 1 s заполнена (больше двух электронов в нее не втиснешь), то практически не возникает тенденции уводить у других атомов электроны. Гелий химически инертен.
Ядро лития имеет заряд 3. Состояния электрона опять будут водородоподобны, и тройка электронов займет три нижних уровня энергии. Два попадут в состояния 1 s, a третий пойдет в состояние n =2. Но вот с l =0 или с l =1? В водороде у этих состояний энергия одна и та же, в других же атомах это не так, и вот по какой причине. Вспомним, что у 2 s -состояния есть некоторая амплитуда того, что оно окажется вблизи ядра, а у 2 р такой амплитуды нет. Это означает, что 2 s -электрон как-то ощутит тройной электрический заряд ядра Li, а 2 р -электрон останется там, где поле выглядит как кулоново поле единичного заряда. Добавочное притяжение понизит энергию 2 s -состояния по сравнению с энергией 2 р -состояния. Уровни энергии примерно окажутся такими, как показано на фиг. 17.8 (сравните с соответствующей диаграммой на фиг. 17.7 для водорода).
Поскольку разные l -состояния обладают разными энергиями, то каждое значение l отвечает некоторой подоболочке из 2(2 l +1) возможных состояний (с различными т и различными направлениями спина). У всех у них энергия одинакова с точностью до некоторых слабых эффектов, которыми мы пренебрежем.
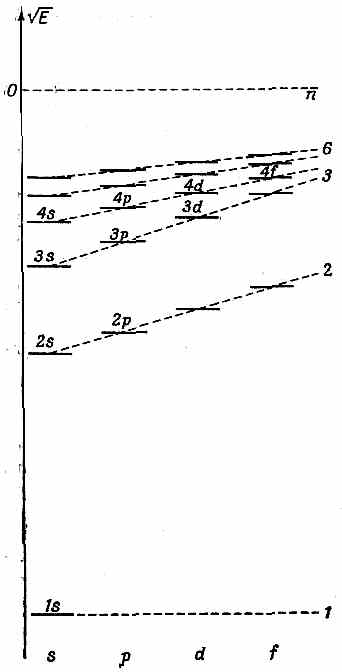
Фиг. 17.8. Схематическая диаграмма уровней анергии атомного электрона в присутствии других электронов. Масштаб иной, нежели па фиг. 17.7.
Значит, в атоме лития два электрона будут в 1 s -состояниях, а один — в 2 s -состоянии. Поскольку электрон в 2 s -состоянии обладает более высокой энергией, чем электрон в 1s-состоянии, то его сравнительно легко удалить. Ионизационная энергия лития всего 5,4 эв, и он весьма активен химически.
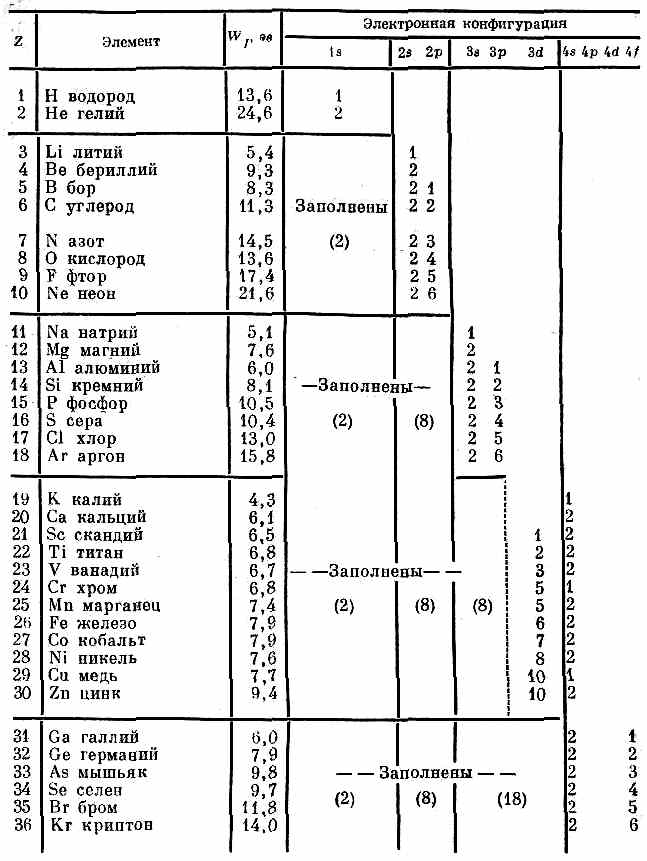
Так постепенно перед вами развертывается вся картина; в табл. 17.2 мы привели список первых 36 элементов, отметив состояния, занимаемые электронами в основном состоянии каждого атома. Таблица дает энергию ионизации для наиболее слабо связанного электрона и количество электронов, занимающих каждую «оболочку», т. е. состояние с одним и тем же п.
Таблица 17.2 • ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ ПЕРВЫХ
36 ЭЛЕМЕНТОВ (число электронов в разных состояниях)
Поскольку разные l -состояния обладают разными энергиями, то каждое значение l отвечает некоторой подоболочке из 2(2 l +1) возможных состояний (с различными m и различными направлениями спина). У всех у них энергия одинакова с точностью до некоторых слабых эффектов, которыми мы пренебрежем.
Бериллий похож на литий, только у него в 2 s -состоянии находятся два электрона, а в заполненной 1s-оболочке тоже два.
У бора 5 электронов. Пятый должен уйти в 2 p -состояние. Всего бывает 2x3 = 6 разных 2 p -состояний, поэтому можно продолжать добавлять по электрону, пока не дойдем до 8. Так мы доберемся до неона. Добавляя эти электроны, мы увеличиваем также Z, поэтому все электронное распределение все теснее и теснее стягивается к ядру и энергия 2 p -состояний все снижается и снижается, К тому времени, когда мы достигнем неона, энергия ионизации возрастет до 21,6 эв. Неон легко своего электрона не отдает. У него к тому же больше нет пустых мест на орбите, которые можно заполнить, так что и чужие электроны ему не нужны. Стало быть, неон химически инертен. У фтора есть пустое место, попав на которое, электрон может оказаться в состоянии с низкой энергией, поэтому в химических реакциях фтор очень активен.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 348; Нарушение авторских прав?; Мы поможем в написании вашей работы!