
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Третичная структура белка
|
|
|
|
А Б
В виде складчатого слоя
Если водородные связи образуются между участками изгиба одной цепи, то их называют внутрицепочечными, если между цепями – межцепочечные. Водородные связи располагаются перпендикулярно полипептидной цепи. Если связанные несколько цепей полипептида направлены противоположно, а N- и С-концы не совпадают, то возникает антипараллельная β–структура, если совпадают – параллельная β-струк- тура (рис.19).

Рис.19. Параллельный и антипараллельный β-складчатые слои:
β-структуры обозначены широким стрелками. А – анти -
параллелльная β-структура; Б – параллельные β-структуры
Вследствие особенностей строения аминокислот содержание α- спиралей и β-структур в белках различаются. Вторичная структура белков миоглобина, гемоглобина, тропомиозина представлена только α-спиралями (рис.20);
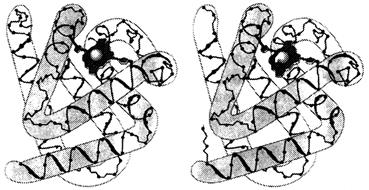
Рис 20. Восемь α-спиралей в структуре миоглобина (А) и
β-цепи гемоглобина (Б).
у белков лактатдегидрогеназы и фосфоглицераткиназы соотношение участков цепей в α-спирали и β-структуре совпадает в количественном и пространственном соотношении (45% - α-спираль и 25% - β-структура) (рис.21);
 Б
Б
А
Рис. 21. α-спирали и β-структуры в домене лактатдегидрогеназы (А) и фосфоглицераткиназы (Б).
к белкам, имеющим только β-структуры, относятся иммуноглобулины и некоторые ферменты (рис.22).
Беспорядочный клубок – это участки пептидной цепи, лишенные какой-либо правильной, упорядоченной пространственной организации. В этих участках цепь может легко изгибаться, принимать конфигурацию петель и колец, в отличие от α–спирали и β–структуры. Но для данного индивидуального белка эти изменения будут иметь строго фиксированную конформацию, определяемую аминокислотными остатками данного участка цепи и окружающих его участков.
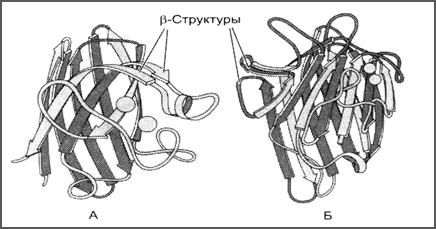 |
Рис.22. β-складчатая вторичная структура в константном домене
иммуноглобулина (А) и ферменте супероксиддисмутазе (Б)
Третичная структура белка – это трехмерная пространственная структура, образующаяся за счет взаимодействия между радикалами аминокислот, находящимися на значительном расстоянии друг от друга. При этом, полипептид в конформации либо α-спирали, либо β-структуры или бесструктурного клубка, укладывается в пространстве, образуя конформацию белковой глобулы.
Радикалы, взаимодействующие между собой, могут находиться весь- ма далеко друг от друга в цепи; сближение происходит за счет изгибов этой цепи в пространстве. В зависимости от своего химического строения радикалы приобретают различные свойства, образуя разные типы связей (табл.2). Образование большого количества межрадикальных связей приводит к образованию термодинамически устойчивой конформации – белковой глобулы, которая является третичной структурой белка.
При укладке полипептидная цепь стремиться принять энергетически наиболее выгодную форму (рис.23). При этом гидрофобные радикалы аминокислот стремятся к объединению внутри глобулы у белков растворимых в воде; между ними возникают гидрофобные и вандер- ваальсовые взаимодействия. В результате внутри глобулы образуется гидрофобное ядро. Гидрофильные радикалы снаружи ядра, связанные водородными связями вторичной структуры, не могут взаимодействовать с водой и это сохраняет плотность гидрофобного ядра. Третичную структуру некоторых белков стабилизируют ковалентные дисульфидные связи между ЅH-группами цистеина. Наиболее часто такие связи образуются у белков, секретируемых во внеклеточное пространство. Считается, что эти связи предотвращают денатурацию белка (гормон инсулин, иммуноглобулины). Белки с одинаковой первичной структурой в одинаковых условиях приобретают одинаковую пространственную структуру, определяющую их функцию. Функционально активные белки называются нативными.
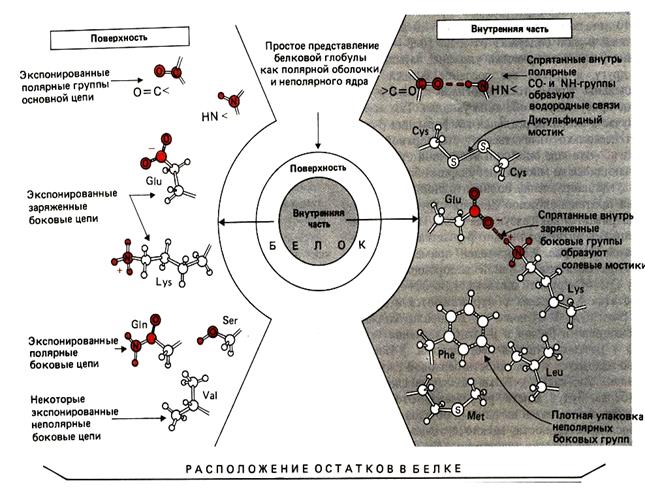
Рис.23. Различные типы структур глобулярных белков
Некоторая часть гидрофобных радикалов остается на поверхности глобулы, обеспечивая возможность контакта с лигандами, имеющими гидрофобные группы. Таким образом, на уровне третичной структуры белка образуются активные центры, обеспечивающие связь с лигандами, то есть формируется его функциональная активность.
Вместе с тем, третичная структура белка обладает определенной подвижностью, обратимо изменяющей данную конформацию. Эти изменения не нарушают основного плана структуры и связаны с разрывами одних и образованием других связей. Причинами изменений могут быть: 1- влияние тепла, когда связи могут разрываться и вновь смыкаться; 2 - влияние специальных веществ – регуляторов; 3 - химическая модификация белков (фосфорилирование); 4 - выполнение белком его функции (конформация гемоглобина с присоединенным О2 отличается от таковой без О2). Изменение конформации белков – важнейший способ регуляции их биологической активности (изменение активности ферментов).
Если конформационные изменения вызваны разрывом большого количества связей, то это приводит к разрушению ее нативной структуры и к потере специфической функции белка. Такой процесс называется денатурацией (рис.24).
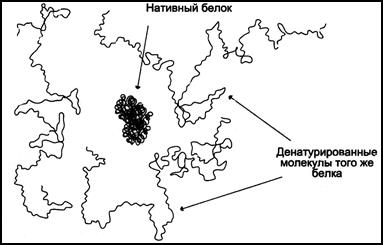
Рис. 24. Структура нативной молекулы белка (в центре) и трех денатурированных молекул этого же белка
При этом пептидные связи не нарушаются, то есть первичная структура не изменяется. К факторам, вызывающим денатурацию относятся: температу- ра (свыше 50°), действие органических веществ (этиловый спирт, фенол), кислот, щелочей, солей тяжелых металлов (меди, ртути, свинца и др.) и пр.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 2184; Нарушение авторских прав?; Мы поможем в написании вашей работы!