
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторная работа № 5
|
|
|
|
Опыт 3. Гидролиз солей различного типа
Опыт 2. Реакции идущие с образованием слабых электролитов
Опыт 1. Реакции в растворах электролитов, идущие с образованием труднорастворимого вещества.
Молекулярное уравнение реакции:
__________________________________________________________________
Полное ионно-молекулярное уравнение реакции:
__________________________________________________________________
Краткое ионно-молекулярное уравнение реакции:
__________________________________________________________________
Произведение растворимости: ________________________________________
Молекулярное уравнение реакции:
__________________________________________________________________
Полное ионно-молекулярное уравнение реакции:
__________________________________________________________________
Краткое ионно-молекулярное уравнение реакции:
__________________________________________________________________
Константа диссоциации слабого электролита
__________________________________________________________________
Уравнение диссоциации 1-й соли _____________________________________
Основание и кислота, образовавшие соль: __________________________________________________________________
Гидролиз идет по ___________________________________________________
Ионное уравнение гидролиза: ________________________________________
Молекулярное уравнение гидролиза
__________________________________________________________________
2 ступень гидролиза (если есть) ______________________________________
__________________________________________________________________
3 ступень гидролиза (если есть) _______________________________________
__________________________________________________________________
Реакция среды, рН среды ____________________________________________
Уравнение диссоциации 2-й соли _____________________________________
Основание и кислота, образовавшие соль: __________________________________________________________________
Гидролиз идет по ___________________________________________________
Ионное уравнение гидролиза: ________________________________________
Молекулярное уравнение гидролиза
__________________________________________________________________
2 ступень гидролиза (если есть) ______________________________________
__________________________________________________________________
3 ступень гидролиза (если есть) _______________________________________
__________________________________________________________________
Реакция среды, рН среды ____________________________________________
Вывод:____________________________________________________________
____________________________________________________________________________________________________________________________________
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель работы: освоение методики составления уравнений окислительно-восстановительных реакций методом электронного баланса, установление возможности их протекания.
Важнейшие понятия: окислительно-восстановительные реакции, степень окисления, процесс окисления и восстановления, окислитель и восстановитель, окислительно-восстановительный потенциал, ЭДС реакции.
Следует уметь: определять степень окисления элемента в соединении, находить окислитель и восстановитель, описывать процессы окисления и восстановления, уравнивать окислительно-восстановительные реакции по методу электронного баланса, рассчитывать ЭДС реакции, исходя из значений потенциалов; прогнозировать возможность протекания окислительно-восстановительной реакции.
Экспериментальная часть
Работа выполняется по вариантам:
1.  ;
;
 ;
;
2. 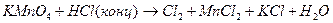 ;
;
Al + NaOH + H2O → Na[Al(OH)4] + H2;
3. 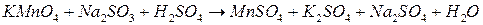 ;
;
Zn + HCl (р-р)→ ZnCl2 + H2;
4.  ;
;
 Zn + HNO3 (конц) → Zn(NO3)2 + NO2↑ + H2O;
Zn + HNO3 (конц) → Zn(NO3)2 + NO2↑ + H2O;
5. 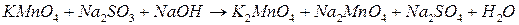 ;
;
 (конц.)
(конц.)  ;
;
В пробирку внесите по 3-4 капли растворов исходных веществ (или кусочек металла). Отметьте изменение окраски раствора, выпадение осадка или выделение газа. Составьте электронные уравнения полуреакций окисления и восстановления, проверьте электронный баланс, полученные коэффициенты расставьте в молекулярном уравнении. Рассчитайте ЭДС реакций, воспользовавшись значениями окислительно-восстановительных потенциалов (Приложение, табл. 5). Сделайте вывод о возможности протекания реакции.
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №5
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель работы: выполнение окислительно-восстановительных реакций, освоение методики составления уравнений окислительно-восстановительных реакций методом электронного баланса, установление возможности их протекания.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Степень окисления это ______________________________________________
____________________________________________________________________________________________________________________________________
Окислительно-восстановительные реакции протекают ___________________
__________________________________________________________________
Окислительно-восстановительные реакции отличаются от реакций обмена
__________________________________________________________________
Окислитель ________________________________________________________
Процесс окисления _________________________________________________
__________________________________________________________________
Восстановитель ____________________________________________________
Процесс восстановления _____________________________________________
__________________________________________________________________
Приведите примеры типичных окислителей: ____________________________
__________________________________________________________________
Приведите примеры типичных восстановителей: ________________________
__________________________________________________________________
Окислительно-восстановительная способность веществ количественно характеризуется ______________________________________________________
Для теоретического предсказания возможности протекания окислительно-восстановительной реакции нужно ____________________________________
__________________________________________________________________
Приведите формулу, по которой рассчитывается ЭДС реакции
__________________________________________________________________
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 938; Нарушение авторских прав?; Мы поможем в написании вашей работы!