
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентная связь
|
|
|
|
Существует между электрически нейтральными атомами в молекуле (например Н2, О2, N2, С12, HF, СCl4, NH3 и др.). Объясняется чисто квантовыми представлениями.
Ковалентная связь обладает свойством насыщения, которое выражается в наличии определенной валентности атомов – числа присоединяемых атомов.
Пример: атом водорода может быть связан только с одним атомом водорода, атом углерода может связать четыре атома водорода (CH4 – метан), азот – три атома H, не более (NH3).
В). Понятие обменного взаимодействия
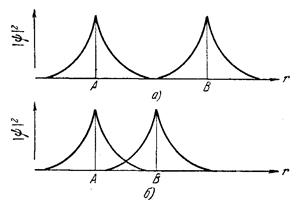
Рассмотрим две микрочастицы с полуцелым спином, состояние которых описывается волновыми функциями ψ1 и ψ2. При сближении этих частиц на расстояние порядка длины волны де Бройля волновые функции перекрываются в некоторой области пространства (квадрат волновой функции не равен нулю - рис.14-4). В этой области с равной вероятностью можно найти частицу 1 и частицу 2, т.е. они становятся неразличимыми, или тождественными. Если спины частиц параллельны, то частицы не могут подойти близко друг к другу, так как должны находиться согласно принципу Паули в разных состояниях, энергия взаимодействия такого состояния положительна и частицы отталкиваются. Если же спины частиц антипараллельны, то частицы подходят друг к другу на очень малое расстояние и могут образовать устойчивое соединение, обмениваясь между собой местами. Энергия такого соединения отрицательна (называется обменной энергией) и между частицами существуют силы притяжения (обменные силы).
Г). Образование ковалентной связи на примере молекулы водорода.
Если расстояние между атомами R велико, то атомы не взаимодействуют и полная энергия системы W равна суммарной энергии состояния атома водорода:
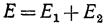
При сближении атомов между ними возникает взаимодействие, характеризуемое некоторой энергией ΔE, зависящей от расстояния между атомами, поэтому, полная энергия E системы выразится следующим образом:
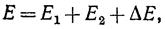
Величина ΔE вычисляется путем решения уравнения Шредингера для молекулы водорода.
Для параллельных спинов электронов в каждом атоме ΔE > 0, а для случая антипараллельных спинов ΔE <0. Поэтому два водородных атома отталкиваются, если спины электронов параллельны, и притягиваются, если спины антипараллельны.
В водороде отталкивание объясняется кулоновскими силами. В других атомах отталкивание объясняется принципом Паули для электронов. Заполненные электронные оболочки атомов не могут просто проникать друг в друга, так как при взаимном проникновении на каждой из заполненных оболочек атома оказалось бы вдвое больше электронов, чем мест. При сближении атомов электроны из соприкасающихся заполненных оболочек «вытесняются» в более высокие энергетические состояния. Энергия системы возрастает и, следовательно, возникают силы отталкивания.
Д). Объяснение «насыщения» ковалентной связи
Рассмотрим взаимодействие молекулы водорода еще с одним атомом водорода. В молекуле водорода спины электронов антипараллельны (рис. 14-5), - спин электрона в атоме водорода параллелен спину одного из электронов молекулы и анти-параллелен другому. При сближении молекулы и атома возникает обменное взаимодействие.
Но обмен электрона с с электроном b привел бы к тому, что на близком расстоянии друг от друга (в пределах размеров молекулы водорода) оказались бы два электрона с параллельными спинами (а и с). Такое состояние обладает очень большой энергией, при этом возникает отталкивание, а не притяжение.
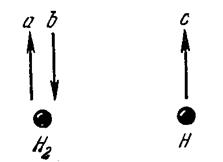
Обмен электрона с с электроном а тоже приводит к отталкиванию. Поэтому атом водорода связывается с одним и только одним водородным атомом. В связи участвуют два электрона с противоположным направлением спинов. В этом и заключается свойство насыщения связи, которое в химии и называют валентностью.
Насыщение ковалентной связи
Вывод:
Для параллельных спинов дополнительный положительный вклад в энергию приводит к тому, что атому отталкиваются на любом расстоянии. Этим объясняется насыщение ковалентной связи.
Молекула водорода может состоять только из двух атомов. Третий атом водорода не может образовать связь с молекулой потому, что его спин непременно будет параллельным одному из спинов электронов в составе молекулы. Параллельность спинов приводит к отталкиванию между ядрами на любом расстоянии.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 457; Нарушение авторских прав?; Мы поможем в написании вашей работы!