
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пожарная безопасность экзотермических процессов
|
|
|
|
К экзотермическим процессам относятся процессы хлорирования, гидрохлорирования, гидрирования, полимеризации, поликонденсации и др.
Процессы хлорирования (гидрохлорирования) связаны с введением атома хлора в органические соединения. Введением хлора в органические соединения получают мономеры, которые используют для производства пластических масс, химических волокон, синтетических каучуков, растворители, ядохимикаты, а также промежуточные продукты органического синтеза. В качестве исходных продуктов в промышленных процессах хлорирования и гидрохлорирования используют горючие углеводородные газы (метан, этан, этилен, пропилен, ацетилен и др.) и горючие жидкости (бензол, толуол, фенол и др.).
Так, хлорированием этилена получают дихлорэтан. Реакция получения
дихлорэтана имеет вид:
СН2=СН2+Сl2àСlСН2-СН2Сl+Q (7.1)
Дихлорэтан - это горючая жидкость с температурой вспышки 27 оС. Применяется в качестве растворителя и сырья для получения хлористого винила, полисульфидного каучука и др.
Гидрохлорированием ацетила получают хлористый винил. Реакция получения хлористого винила имеет вид:
СНºСН+НСlàСН2=СНСl+Q (7.2)
Хлористый винил - это ГГ, пределы распространения пламени в воздухе 3,6 - 33% (об.). Применяется как сырье для получения полимерных материалов. Условия осуществления процессов хлорирования (гидрохлорирования) в промышленности весьма разнообразны. Их осуществляют в присутствии катализаторов (инициализаторов) при нормальном или повышенном давлениях и высокой температуре. В качестве катализаторов чаще всего используют галогениды металлов (FеСl3, АlСl3, НgСl2), а в качестве инициатора – перекись бензоила. Процессы протекают в жидкой или парообразной фазе. Конечные и промежуточные продукты в большинстве случаев являются также горючими жидкостями (дихлорэтан, хлорбензол, дихлорэтилен) и сжиженными газами (хлористый винил, хлористый метил и т.д.)
Хлор, применяемый в процессах хлорирования (гидрохлорирования), является сильным окислителем, поддерживает горение многих веществ, образует взрывчатые смеси с органическими веществами, обладает токсичностью. Хлористый водород и хлор вызывают коррозию оборудования. В качестве хладагентов, помимо воды, применяются ГГ: аммиак, водород, этилен.
Для отдельных процессов хлорирования (гидрохлорирования) необходим первоначальный подогрев реагентов до 200 - 500 оС. Для нагрева используют ВТ, в том числе органические, водяной пар, топочные газы.
Пожарная опасность процессов хлорирования (гидрохлорирования) характеризуется горючей средой, которую составляют пары органических веществ и углеводородные газы, и образующие с хлором взрывоопасные смеси.
Для проведения процессов хлорирования (гидрохлорирования) используют реакторы вытеснения непрерывного действия трубчатого или камерного типа с изотермическим или адиабатическим режимом. Повышение температуры в реакционном объеме реактора, которое приводит к повышению скорости реакции, делает реакцию неуправляемой и носит взрывной характер. Причины повышения температуры: прекращение или уменьшение подачи хладагента, загрязнение теплообменной поверхности, подача хладагента с завышенной начальной температурой. При проведении процесса газофазного хлорирования могут иметь место реакции разложения продуктов. При этом образуются газообразные продукты и пары, что может быть причиной повышения давления в реакторе. В газофазных процессах может быть термическое разложение углеводородов с образованием сажи и смолистых продуктов, которые загрязняют поверхности твердого катализатора и увеличивают гидравлическое сопротивление системы. Сажу и смолистые вещества периодически выжигают.
Специфическими источниками зажигания в процессах хлорирования являются: нарушение температурного режима и местные перегревы. Они представляют большую опасность при газофазном гидрохлорировании органических веществ, склонных к взрывному разложению. На поверхности твердого неподвижного перегретого катализатора могут возникнуть локальные очаги процесса разложения, которые распространяются на весь реакционный объем.
Так, ацетилен и особенно продукты его полимеризации при повышенных температурах разлагаются с взрывом.
Высокие температуры наблюдаются в тех зонах реакционного объема, которые наиболее удалены от поверхности теплоотвода. Увеличение температуры в слое неподвижного катализатора от стенки до оси реактора достигает 300 оС и более.
Гидрирование - это процесс непосредственного присоединения водорода к углеродосодержащим веществам. Процессы гидрирования используются в промышленности при получении растворителей, синтетических смол, поверхностноактивных веществ, моторных топлив, технических смазок.
Так, гидрогенизацией оксида углерода получают метанол. Реакция получения метанола имеет вид:
СО+2Н2«СН3ОН+Q (7.3)
Принципиальная технологическая схема процесса гидрирования представлена на рисунке 7.6. Исходное сырье после испарения и подогрева смешивается с водородом, и смесь подается в реактор гидрирования. Образующиеся продукты гидрирования и избыток водорода поступают на разделение. Путем конденсации от продуктов реакции отделяют водород, направляя его (после соответствующей очистки) в узел смешения с сырьем или на сжигание. Из жидкой фазы, отделяя побочные вещества, получают необходимые продукты гидрирования.
Процессы гидрирования проводятся при повышенной температуре (повышается активность катализатора) и давлении, в избытке водорода (увеличивает выход продукта). Процессы гидрирования проводят, как в жидких, так и в парогазовых фазах.
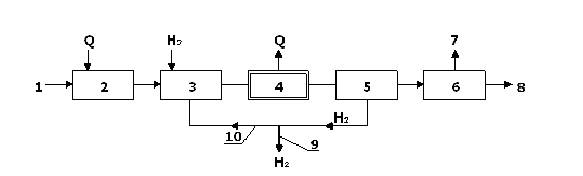
Рисунок 7.6 – Принципиальная технологическая схема процесса гидрирования:
1 - исходное сырье; 2 - испарение; 3 - смешение с водородом; 4 - реактор; 5 - выде-
ление водорода из реакционной смеси; 6 - разделение продуктов гидрирования;
7 - побочные продукты; 8 - продукты гидрирования; 9 - избыточный воздух;
10 - циркуляционный водород.
Для проведения процессов гидрирования применяются реакторы (рисунок 7.7) трубчатого или колонного типов с неподвижным слоем катализатора.

Рисунок 7.7 - Реактор периодического действия для жидкофазного
гидрирования:
1 – исходное сырье; 2 – выносной холодильник; 3 – продукты реакции.
В реакторе катализатор размещается в специальной катализаторной коробке с перфорированным дном. Холодный водород или реакционная смесь подаются в кольцевое пространство между корпусом реактора и катализаторной коробкой для снятия части тепла и предохранения корпуса от действия высоких температур. Кроме того, по высоте коробки в нескольких местах вводится холодный водород. Таким образом, реакторы гидрирования заполнены парами горючей жидкости в смеси с водородом, находящимся под давлением.
Горючую среду в процессах гидрирования образуют горючие жидкости, которые используются в качестве сырья или получаются в результате технологического процесса. Особую опасность представляют горючие жидкости, нагретые в условиях производства до температуры самовоспламенения и более (для нагрева используют ВОТ). Технологическое оборудование, нагретое до температуры более 200 оС и находящееся под давлением газообразного водорода, подвергается активной водородной коррозии.
К специфическим источникам зажигания, которые могут возникать в процессе гидрирования, следует отнести разряды статического электричества и самовозгорание пирофорных соединений при контакте их с воздухом, например, при замене катализатора.
Пути распространения пожара в реакторах гидрирования связаны с возможностью появления неплотностей, повреждений, при повышении давления в реакторе и с выходом наружу паров горючей жидкости и водорода с самовоспламенением их при контакте с воздухом. Причины повышения давления: нарушение температурного режима (перегрев исходного сырья, ухудшение теплоотвода из реакционной зоны); сжатие и измельчение катализатора, что ведет к повышению гидравлического сопротивления; прогар труб, ведущий к авариям и пожару; попадание в реактор жидкого продукта.
Полимеризация - это процесс получения полимерных соединений (полимеров) из низкомолекулярных веществ (мономеров), при этом взаимодействие молекул мономера (или мономеров) не сопровождается выделением побочных низкомолекулярных соединений. В качестве исходных веществ для реакций полимеризации применяются ненасыщенные соединения, имеющие двойные или тройные связи (этилен, ацетилен, винилхлорид, стирол, бутадиен и их производные). При полимеризации происходит разрыв двойной связи, в результате чего молекула реагирует с другими молекулами.
Процессы полимеризации используют для получения пластмасс, каучуков и других веществ.
Поликонденсация - это процесс образования полимеров, при котором взаимодействие молекул мономеров сопровождается выделением побочных низкомолекулярных соединений (воды, спирта, хлористого водорода и др.).
Поликонденсация используется для получения полимеров, синтетических смол, кремнийорганических полимеров.
В качестве исходных веществ для реакций поликонденсации применяют низкомолекулярные вещества, содержащие реакционноспособные группы (гидроксильные, карбонильные, аминогруппы и др.).
В процессах полимеризации и поликонденсации в качестве катализаторов используют металлоорганические соединения, обладающие повышенной химической активностью, могут самовоспламеняться на воздухе (диэтилаллюминийхлорид, триизобутилаллюминий), а в качестве инициаторов - органические перекиси и гидроперекиси (перекись бензоила, перекись водорода, гидроперекись изопропилбензола).
Процессы полимеризации (поликонденсации) в промышленности осуществляются тремя основными способами: блочным (рисунок 7.8), эмульсионным и полимеризацией в растворе. Блочная полимеризация протекает в среде полимеризующегося мономера в присутствии инициатора и под воздействием тепла или только под воздействием тепла – термическая полимеризация. Полимеру не дают остыть и выдавливают их реактора в виде ленты или жилки, которую после охлаждения измельчают, получая полимер в виде гранул.
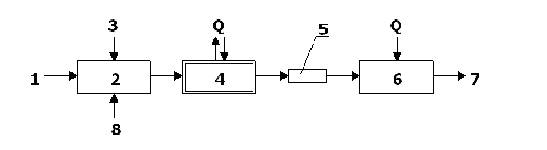
Рисунок 7.8 – Принципиальная технологическая схема блочной полимеризации:
1 – подача исходного мономера; 2 – смеситель; 3 – подача инициатора;
4 – полимеризатор; 5 - выдавливание ленты или жилки полимера; 6 – грануляция;
7 – готовый полимер; 8 – добавки (краситель, регулятор и др.).
Если исходный мономер твердое вещество, его предварительно расплавляют, а затем смешивают с инициатором и другими добавками. В некоторых случаях (например, при получении полистирола) осуществляют предварительную полимеризацию мономера (на 30%), а затем смесь полимера и мономера поступает во вторую стадию полимеризации, на которой полимеризуется почти весь мономер. Блочной полимеризацией получают полистирол, полиэтилен высокого давления и другие вещества.
Эмульсионная полимеризация осуществляется в водной среде или в среде углеводородного растворителя. Мономер, водорастворимый инициатор, стабилизатор и другие добавки распределяются при интенсивном перемешивании в воде, в присутствии эмульгатора, образуя эмульсию. На скорость процесса эмульсионной полимеризации влияют: рН среды, температура, количество инициатора, скорость и интенсивность перемешивания. После окончания процесса эмульсию разрушают, добавляя кислоты или другие электролиты. Эмульсионной полимеризацией получают поливинилхлорид, полистирол.
Полимеризация в растворе проводится в среде растворителя, растворяющего мономер и полимер или только мономер. В первом случае продукт полимеризации представляет собой раствор полимера. В твердом виде полимер получают путем удаления из раствора растворителя и остатков мономера. Это достигается обработкой полимера горячей водой и водяным паром. Если полимер отделяется от воды, он высушивается и гранулируется, а если полимер не растворяется в применяемом растворителе, то по мере образования он выпадает из раствора в твердом виде в осадок и отделяется фильтрованием.
Горючую среду в процессах полимеризации составляют горючие жидкости (стирол, хлоропрен); ГГ (этилен, пропилен), в том числе СГГ (бутадиен, хлористый винил); горючие твердые вещества (фенол, капролактам), инициаторы и катализаторы.
Специфические источники зажигания: тепловое проявление химических процессов, в том числе самовозгорание металлоорганических соединений, тепло химических реакций, нагретые конструкции оборудования (температура при проведении реакции полимеризации колеблется в пределах 0 - 300 оС, а давление – 150 - 200 МПа).
Пути распространения пожара: взрыв, растекание мономеров, растворителей, расплавленных полимеров, горение их на больших площадях с выделением токсичных продуктов разложения.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1799; Нарушение авторских прав?; Мы поможем в написании вашей работы!