
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая характеристика элементов и их соединений. Генетические связи неорганических и органических веществ
|
|
|
|
| 4.1. Типичные свойства представителей основных классов химических соединений.Прогноз, планирование и объяснение превращений веществ на основе представлений о типичных химических свойствах простых веществ и соединений. | *Кислород проявляет типичные свойства простого вещества-неметалла, когда… 1) сера горит на воздухе 2) перманганат калия (марганцовка) разлагается при нагревании 3) вода разлагается электрическим током 4) углекислый газ растворяется в воде *С простым веществом водородом могут взаимодействовать все вещества из списка: 1) кислород, сера, оксид меди 2) сероводород, хлороводород, азот 3) хлорид натрия, медь, кислород 4) сера, азот, вода *При получении соли из кислоты и оксида металла вторым продуктом реакции будет... 1) водород 2) вода 3) кислотный оксид 4) металл *Реакция обмена между солью и кислотой приводит к образованию... 1) другой соли и основания 2) другой соли и кислоты 3) соли и воды 4) двух солей ** Гидроксид натрия вступит в реакции со всеми веществами из списка... 1) сульфат меди, серная кислота, оксид калия 2) хлорид железа (III), азотная кислота, оксид углерода (IV) 3) серная кислота, гидроксид кальция, хлорид меди 4) оксид серы (VI), оксид кальция, вода ** При постепенном приливании раствора гидроксида калия к похожим по виду растворам в одной из пробирок появился и вскоре исчез белый осадок. Из перечисленных, скорее всего в этой пробирке находился раствор... 1) хлорида натрия 2) хлорида цинка 3) нитрата калия 4) соляной кислоты *** «... — вещество, открытое сэром Гемфри Деви. Оно очень энергично действует на воду, и это воздействие будет служить нам для обнаружения воды. Достаточно взять маленький кусочек его и бросить в чашку с водой; как только оно попадет на воду, так сейчас же вспыхивает …». М. Фарадей. Популярные Рождественские лекции. Какое вещество, открытое Г. Деви в 1807 г., М. Фарадей использовал в своих лекциях? Что происходит при взаимодействии этого вещества с водой? ** Для очистки внутренней поверхности чайника от накипи,большую часть которой обычно составляет карбонат кальция, иногда достаточно прокипятить в нем воду, в которую добавлена уксусная кислота. Что должно произойти при этом с накипью? ***Для доказательства того,что найденный кусок желтоватого металл представляет собой не золото, а сплав меди с цинком, химик растворил кусок этого металла в азотной кислоте, затем к полученному раствору добавил по каплям щелочь. Полученный осадок он обработал щелочью, нерастворившуюся часть отделил, а к полученному бесцветному раствору стал добавлять по каплям кислоту. Что и зачем он делал? *** В распоряжении юного химика оказались металлический цинк, соляная кислота, гидроксид натрия, медный купорос и мел. Какие новые вещества он сможет получить? *** В одной научной работе, напечатанной в 1754 г.,описываются следующие опыты (названия веществ даны те, которые были приняты в то время): 1) при сильном нагревании белая магнезия превращается в жженую магнезию, причем масса жженой магнезии почти в два раза меньше, чем масса взятой белой магнезии; 2) при обработке белой магнезии серной кислотой происходит сильное вскипание и образуется эпсомская соль; 3) жженая магнезия с серной кислотой дает ту же соль, но без вскипания; 4) если на эпсомскую соль подействовать поташом, то выпадает осадок белой магнезии, из раствора же выпариванием можно выделить купоросный камень; 5) при действии серной кислоты на поташ происходит вскипание и образуется купоросный камень; 6) едкое кали с серной кислотой также дает купоросный камень, но без вскипания. На основании этих данных был сделан вывод, что в состав белой магнезии входит какое-то летучее вещество (оно было названо фиксированным воздухом), которое выделяется из белой магнезии при ее прокаливании или при действии на нее кислоты. Расшифруйте эту схему превращения и проделайте опыты, которые были описаны. |
| 4.2. Состав и свойства простых веществ и типичных представителей основных классов неорганических соединений, образуемых важнейшими элементами.Соответствие формул типичных соединений свойствам атомов элементов (валентность, относительная электроотрицательность, размеры атомов). Прогноз типичного химического поведения соединений на основании расположения элемента в ПСЭ. Закономерности образования элементами типичных соединений и прогноз их свойств в сравнении с другими элементами ПСЭ. | * Металлические свойства выражены сильнее у олова, чем у кремния, так как: 1) радиус атома олова меньше, чем радиус атома кремния 2) радиус атома олова такой же, как и у атома кремния, но больше заряд ядра 3) валентные электроны атома олова расположены дальше от ядра, чем у атома кремния 4) у атома олова меньше валентных электронов, чем у кремния * Окислительные свойства простых веществ возрастают в ряду элементов: 1) бром, углерод, кислород 2) водород, углерод, азот 3) хлор, фосфор, сера 4) фтор, азот, водород *Восстановительные свойства характерны для соединений: 1) азота (-3) и серы (-2) 2) серы (+4) и азота (+5) 3) азота (+3) и азота (+5) 4) фосфора (+5) и фтора (-1) *Ярко выраженные кислотные свойства способны проявлять водородные соединения: 1) кислорода и серы 2) хлора и брома 3) азота и фосфора 4) углерода и кремния *Типичными соединениями неметаллов VI группы будут: 1) ЭО, ЭО2, ЭН4, Н2ЭО3 2) ЭО2, ЭО3, Н2Э, Н2ЭО3, Н2ЭО4 3) Э2О3, Э2О5, Н3Э, НЭО3, Н3ЭО4 4) ЭО2, ЭО3, Н4Э, Н2ЭО3, Н3ЭО4 *.Элемент образует высший оксид состава RO3. Соответствующий ему гидроксид является... 1) щелочным 2) основным 3) кислотным 4) амфотерным * Про элементы Mg и S можно сказать, что... 1) высшие оксиды и гидроксиды этих элементов кислотные 2) высшие оксиды и гидроксиды этих элементов основные 3) оксиды и гидроксиды серы кислотные, а магния - основные 4) магний образует гидроксид, а сера - нет *Только основания перечислены в списке: 1) гидроксид железа (III), нитрат натрия, сульфат меди 2) гидроксид натрия, гидроксид калия, гидроксид меди (II) 3) гидроксид натрия, оксид калия, оксид азота 4) гидроксид кальция, оксид углерода, карбонат кальция **Распределитеформулысоединений хрома по степени окисления его атома: CrSO4, NaCr(OH)4, Na3Cr(OH)6, CrO3, Cr2(SO4)3, Na2CrO4, Cr2O3, Na2Cr2O7, Cr(OH)3, CrO2(OH)2 *** Определите элементы А, В и С и формулы их соединений, если: —элементы А и В принадлежат к I группе, а элемент С – к VI группе периодической системы; —соединение элементов А и С окраску фиолетового раствора лакмуса не изменяет; —при взаимодействии простого вещества, образованного В, с соединением элементов А и С образуется вещество, окрашивающее лакмус в синий цвет. *** Определите элементы А, Б и В и составьте формулы их соединений, о которых идет речь, если: —один из этих элементов принадлежит ко II группе, другой – к IV группе и третий – к VI группе периодической системы; —элементы А и В принадлежат к одному и тому же периоду и образуют друг с другом два соединения: одно горючее и одно негорючее; —соединение всех трех элементов широко распространено в природе и применяется в производстве строительных материалов. *** Оксиду семивалентного хлора соответствует хлорная кислота состава HClO4. Такому же оксиду иода соответствует не только кислота HIO4, но и кислота, имеющая формулу которой H5IO6. Аналогичную закономерность можно проследить, сравнивая формулы кислот, соответствующих пятивалентным оксидам азота, фосфора и висмута. Объясните наблюдаемую закономерность, на основании изменений свойств атомов в соответствующих подгруппах ПСЭ. |
| 4.2. Состав и свойства типичных представителей основных классов органических соединений. Прогноз и планирование возможных изменений состава и строения типичных представителей основных классов органических соединений на основании структурной формулы и характера связывания атомов. Простейшая типология возмож-ных превращений органических веществ и условия их проведения. Сопоставление состава и строения и возможных химических превращений с функциями биологически важных органических веществ. | * В органическом веществе C2H6O углерод проявляет валентность:
1) II
2) IV
3) VI
4) II и VI
* Не существует вещества, формула которого...
1) C2H2
2) C2H4
3) C2H6
4) C2H8
*Состав углеводорода, молекулы которого содержат в углеродном скелете простые и одну двойную связь, соответствует формуле...
1) С7H8
2) С10H20
3) С4H10
4) С6H6
*Названию вещества 2,2-диметилбутан соответствует формула...
1) С4Н10
2) С5Н12
3) С6Н12
4) С6Н14
* К спиртам может относиться вещество, формула которого
1) С4Н8О2
2) С4Н10О2
3) С4Н8О
4) С4Н10О
**Каких веществ больше – имеющих формулуC5H12 или формулу C5H10?
** В молекулах белка каждые две аминокислоты связываются последовательно друг с другом так, что в итоге высвобождается молекула воды. Какая из формул, иллюстрирующая простейший продукт такого связывания, записана правильно?
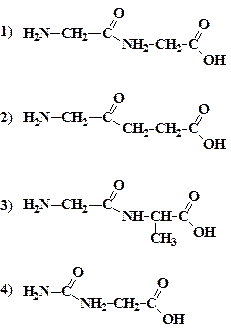 ** В большинстве научных книг для изображения формул органических веществ используются условные изображения углеродных «скелетов» их молекул. Расшифруйте изображения, приведенные ниже. Каковы формулы этих веществ? Как они называются?
** В большинстве научных книг для изображения формул органических веществ используются условные изображения углеродных «скелетов» их молекул. Расшифруйте изображения, приведенные ниже. Каковы формулы этих веществ? Как они называются?
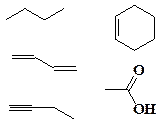 ***Ученик записал формулы продуктов, которые должны были получиться в реакциях, но работу пришлось переделывать. Найдите ошибки и запишите заданные ему уравнения реакций правильно.
1) CH4 + Br2 (облучение) ® CH2Br2 + H2
2) С2H6 + Cl2 (облучение)® C2H6Cl2
3) C2H4 + 2Cl2 ® C2H4Cl2 + 2HCl
4) CH2=CH2 + H2O ® H-CH2-H + O=CH2
*** Два ученика выполняли задание по органической химии. Требовалось определить, что получается при действии гидроксида натрия на вещество, состав которого C2H4О2. Выполнив задание, они решили сверить ответы. –У тебя неправильно! – сказал первый ученик своему приятелю, - там получаются два вещества, одно из них вода! –Нет, это у тебя неправильно! Там получаются два веществ, но одно из них не вода, а спирт! Оказалось, оба выполнили задание правильно. Как такое могло получиться?
***Ученик записал формулы продуктов, которые должны были получиться в реакциях, но работу пришлось переделывать. Найдите ошибки и запишите заданные ему уравнения реакций правильно.
1) CH4 + Br2 (облучение) ® CH2Br2 + H2
2) С2H6 + Cl2 (облучение)® C2H6Cl2
3) C2H4 + 2Cl2 ® C2H4Cl2 + 2HCl
4) CH2=CH2 + H2O ® H-CH2-H + O=CH2
*** Два ученика выполняли задание по органической химии. Требовалось определить, что получается при действии гидроксида натрия на вещество, состав которого C2H4О2. Выполнив задание, они решили сверить ответы. –У тебя неправильно! – сказал первый ученик своему приятелю, - там получаются два вещества, одно из них вода! –Нет, это у тебя неправильно! Там получаются два веществ, но одно из них не вода, а спирт! Оказалось, оба выполнили задание правильно. Как такое могло получиться?
|
| 4.3. Генетические связи простых веществ и неорганических соединений элементов. Генетические связи органических соединений. | |
| Подбор реагентов и выбор условий, позволяющих осуществлять последовательные превращения генетического круга веществ, содержащий данный элемент. Объяснение круговорота важнейших химических элементов в природе. Использование схем генетических превращений веществ для обоснования принципиальной возможности получения органических соединений заданного состава и строения из органических и неорганических реагентов. | *Азот входит в состав всех соединений, перечисленных в списке:
1) аммиак, карбонат натрия, хлорид аммония
2) сульфат натрия, сульфат аммония, нитрат бария
3) аммиак, нитрат натрия, хлорид аммония
4) нитрат кальция, метан, карбонат натрия
*В цепочке превращений
 продуктом X и реагентами A, B, C будут:
1) SO3 и O2, KOH, Ba(OH)2;
2) SO3 и O2, KCl, BaCl2;
3) SO2 и O2, KOH, Ba(OH)2;
4) SO2 и KOH, O2, Ba(OH)2
*Для получения сульфата меди (II) из металлической меди нужно применить последовательно следующие реагенты:
1)S, O2;
2) O2, SO2;
3) O2, H2SO4;
4) SO2, O2
*Для последовательного превращения этилена в этиловый спирт и в уксусную кислоту можно использовать набор веществ…
1) воду, кислород
2) щелочь, воду
3) водород, воду
4) щелочь, серную кислоту
** Доказать, что полученное вещество является именно хлоридом меди, можно, последовательно действуя на его водный раствор...
1) хлоридом цинка и хлоридом натрия
2) металлическим серебром и хлоридом железа (III)
3) гидроксидом железа и гидроксидом натрия
4) металлическим железом и нитратом серебра
** Из медно-серебряного сплава нужно получить чистое серебро и чистую медь. Для этого сплав растворяют в азотной кислоте и избыток азотной кислоты нейтрализуют гидроксидом натрия. Как поступать дальше, чтобы выделить сначала чистое серебро, а затем из оставшегося раствора получить чистую медь?
*** Грозовые разряды в атмосфере вызывают соединение азота с кислородом с образованием оксида, который под действием кислорода и воды последовательно превращается в другой оксид и кислоту, попадающую с атмосферными осадками в почву. Наличие в почве некоторого количества известных минеральных солей приводит к накоплению нитратов, позволяющих растениям усваивать азот. Составьте уравнения происходящих реакций. Для чего нужны нитраты растениям?
*** В природных водах из некоторых подземных источниковприсутствует железо,главным образом в виде гидрокарбоната, который под действием воды и кислорода воздуха постепенно превращается в гидроксид железа (III), окрашивающий известковый налет в сосудах для кипячения воды. Составьте уравнения происходящих реакций.
*** В приведенных схемах превращений соединений элементаЕ буквами зашифрованы элементы кислород и водород. Что это за элемент? Составьте уравнения протекающих реакций.
E2 + G2 → EG
EG + G2 → EG2
EG + EG2 → E2G3
E2G3 + L2G → LEG2
LEG2 + G2 → LEG3
LEG3 → EG2 + G2 + L2G
EG2 + M → E2 + MG2
E2 + L2 → EL3
***В 1862 г. известный немецкий химик Фридрих Велер попытался получить некоторый металл спеканием извести с углем. В результате была получена серая масса, которая, по мнению Велера, ни на что не была пригодна. Ученый выбросил ее на мусорную свалку. Каково же было его удивление, когда под дождем из мусорной кучи начал выделяться газ, сгорающий при поджигании ярким коптящим пламенем. На рубеже ХIХ и XX веков этот газ начал широко использоваться для получения целого ряда органических веществ из обычного угля. Какие важные вещества можно получить таким образом?
продуктом X и реагентами A, B, C будут:
1) SO3 и O2, KOH, Ba(OH)2;
2) SO3 и O2, KCl, BaCl2;
3) SO2 и O2, KOH, Ba(OH)2;
4) SO2 и KOH, O2, Ba(OH)2
*Для получения сульфата меди (II) из металлической меди нужно применить последовательно следующие реагенты:
1)S, O2;
2) O2, SO2;
3) O2, H2SO4;
4) SO2, O2
*Для последовательного превращения этилена в этиловый спирт и в уксусную кислоту можно использовать набор веществ…
1) воду, кислород
2) щелочь, воду
3) водород, воду
4) щелочь, серную кислоту
** Доказать, что полученное вещество является именно хлоридом меди, можно, последовательно действуя на его водный раствор...
1) хлоридом цинка и хлоридом натрия
2) металлическим серебром и хлоридом железа (III)
3) гидроксидом железа и гидроксидом натрия
4) металлическим железом и нитратом серебра
** Из медно-серебряного сплава нужно получить чистое серебро и чистую медь. Для этого сплав растворяют в азотной кислоте и избыток азотной кислоты нейтрализуют гидроксидом натрия. Как поступать дальше, чтобы выделить сначала чистое серебро, а затем из оставшегося раствора получить чистую медь?
*** Грозовые разряды в атмосфере вызывают соединение азота с кислородом с образованием оксида, который под действием кислорода и воды последовательно превращается в другой оксид и кислоту, попадающую с атмосферными осадками в почву. Наличие в почве некоторого количества известных минеральных солей приводит к накоплению нитратов, позволяющих растениям усваивать азот. Составьте уравнения происходящих реакций. Для чего нужны нитраты растениям?
*** В природных водах из некоторых подземных источниковприсутствует железо,главным образом в виде гидрокарбоната, который под действием воды и кислорода воздуха постепенно превращается в гидроксид железа (III), окрашивающий известковый налет в сосудах для кипячения воды. Составьте уравнения происходящих реакций.
*** В приведенных схемах превращений соединений элементаЕ буквами зашифрованы элементы кислород и водород. Что это за элемент? Составьте уравнения протекающих реакций.
E2 + G2 → EG
EG + G2 → EG2
EG + EG2 → E2G3
E2G3 + L2G → LEG2
LEG2 + G2 → LEG3
LEG3 → EG2 + G2 + L2G
EG2 + M → E2 + MG2
E2 + L2 → EL3
***В 1862 г. известный немецкий химик Фридрих Велер попытался получить некоторый металл спеканием извести с углем. В результате была получена серая масса, которая, по мнению Велера, ни на что не была пригодна. Ученый выбросил ее на мусорную свалку. Каково же было его удивление, когда под дождем из мусорной кучи начал выделяться газ, сгорающий при поджигании ярким коптящим пламенем. На рубеже ХIХ и XX веков этот газ начал широко использоваться для получения целого ряда органических веществ из обычного угля. Какие важные вещества можно получить таким образом?
|
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 341; Нарушение авторских прав?; Мы поможем в написании вашей работы!