
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вычисления в титриметрическом анализе
|
|
|
|
Расчеты, связанные с приготовлением и разбавлением растворов.
Из курса неорганической химии известно, что концентрация растворов может быть процентной, молярной, нормальной и моляльной. В практике количественного анализа часто приходится проводить вычисления, связанные с переходом от одной концентрации к другой.
Пример 1. Вычислить молярную концентрации и нормальность 12-процентного раствора серной кислоты H2SO4.
Решение. Для перехода от одной концентрации к другой необходимо использовать табличные данные и найти плотность 12-процентного раствора H2SO4 (d = 1,08). Затем определяют объем 100 г раствора по формуле:
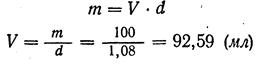
и вычисляют, сколько граммов H2SO4 содержит 1 л 12-процентного раствора серной кислоты:
92,59 мл раствора содержит 12(г)H2SO4
1000 мл »» х (г)H2SO4
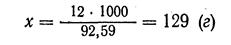
Зная, что в 1 л 12-процентного раствора имеется 129 г серной кислоты H2SO4, определяют молярность:

Пример 2. Сколько миллилитров соляной кислоты (d = 1,19) следует взять, чтобы приготовить 10 л 0,1 н. раствора соляной кислоты НС1?
Решение. Сначала находим, сколько граммов соляной кислоты следует иметь, чтобы получить 1 л 0,1 н. раствора:
г-экв НС1 = 36,46: 1 = 36,46 (г)
Поскольку требуется 0,1 н. раствора следовательно, для приготовления 1 л нужно взять 0,1 г-экв (36,46 / 10), т. е. 3,646 г, для приготовления 10 л; откуда т = 3,646 · 10 = 36,46 (г)
По таблице находим содержание НС1, при d = 1,19 г/см3 оно будет 38,30 %. Составляем соотношение:
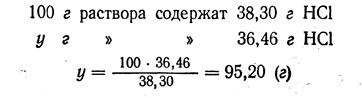
или
| m | = | 95,2 | = 80 (мл) |
| d | 1,19 |
Следовательно, для приготовления 10 л примерно 0,1 н. раствора нужно взять 80 мл соляной кислоты (d = 1,19), отмерив ее мерным цилиндром, и довести водой до объема 10 л.
Пример 3. Сколько граммов карбоната натрия Nа2СО3 потребуется для приготовления 1 л 0,2 н. раствора его.
Решение
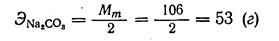
Для приготовления 1 л 0,2 н. раствора карбоната натрия необходимо взять mNа2СО3 (53,0 · 0,2) = 10,6, а для 2 л раствора -21,2 г.
Пример 4. Вычислить молярность 0,3 н. раствора сульфата хрома Cr2(so4)3
Г-экв Cr2(so4)3 равен 1/6 моль, поэтому молярность:

т. е. молярность 0,3 н. раствора сульфата хрома Cr2(so4)3 будет равна 0,05.
Пример 5. Сколько нужно добавить воды к 100 мл 0,8 н. раствора соляной кислоты НС1, чтобы получить 0,2 н. раствор?
Решение. Известно, что произведение объема раствора на его нормальность равно числу грамм-эквивалентов данного соединения в этом объеме, поэтому в данном случае можно применить равенство:

Cколько же нужно добавить воды к 100 мл 0,8 н. раствора, чтобы получить 0,2 н. раствор?
Vн2о = V2 - V1 = 400 — 100 = 300 (мл).
Пример 6. В каком отношении нужно смешать 90-процентный раствор соляной кислоты с 10-процентным, если требуется получить 40-процентный раствор?
В данном случае целесообразно использовать графический прием «правило креста».
Согласно этому правилу составляем схему:
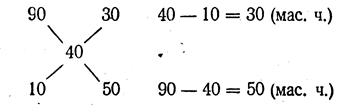
Следовательно, нужно взять 30 мас. ч. 90-процентного раствора и прилить к ним 50 мас. ч. 10-процентного раствора. Если написать «правило креста» в общем виде, то схема будет такова:

где mA и mB — количества растворов А и В, взятые для смешивания,
а, b, с — соответственно концентрации А и В и раствора, получившегося в результате смешивания.
В том случае, если требуется узнать, какие количества растворов нужно взять, чтобы получить нужное количество раствора новой концентрации, сначала определяют отношение mA / mB, a затем делят заданное количество пропорционально этому отношению.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 2484; Нарушение авторских прав?; Мы поможем в написании вашей работы!