
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 3. Энтропия. Второе начало термодинамики
|
|
|
|
Задание
Алфавит состоит из букв А, В, С, Д. Вероятности появления букв равны соответственно:
| P(A) | P(B) | P(C) | P(D) | |
| 1 вариант | 0,25 | 0,25 | 0,34 | 0,16 |
| 2 вариант | 0,45 | 0,05 | 0,27 | 0,23 |
| 3 вариант | 0,13 | 0,24 | 0,4 | 0,23 |
| 4 вариант | 0,77 | 0,05 | 0,1 | 0,08 |
| 5 вариант | 0,06 | 0,2 | 0,3 | 0,44 |
| 6 вариант | 0,5 | 0,2 | 0,2 | 0,1 |
| 7 вариант | 0,3 | 0,3 | 0,2 | 0,2 |
Определить количество информации на символ сообщения, составленного из такого алфавита. (Частная энтропия)
3.1. Введение энтропии (метод Карно-Клаузиуса). Формулировки второго начала
термодинамики.
3.2. Изменение энтропии как критерий возможности самопроизвольного протекания
процесса.
3.3. Методы расчета изменения энтропии. Постулат Планка. Абсолютные значения энтропии..
3.4. Расчет изменения энтропии при химических реакциях.
3.5. Энтропия и термодинамическая вероятность (формула Больцмана).
Границы применимости второго начала термодинамики.
Логическая структура темы:

Первый закон термодинамики не позволяет предсказать направление самопроизвольного течения процесса. Так, самопроизвольный переход теплоты от холодного тела к горячему не противоречит первому закону. Первому закону не противоречат и такие процессы, как самопроизвольное разделение раствора на составляющие его компоненты, самопроизвольное разложение воды при комнатной температуре и др.
Второе начало термодинамики устанавливает критерии необратимости термодинамических процессов. Основное содержание второго начала термодинамики заключается в утверждении существования энтропии и ее неубывания в изолированной системе.
Один из способов доказательства существования у изолированных термодинамических систем функции состояния - энтропии основан на рассмотрении работы тепловых машин и носит название метода Карно-Клаузиуса. Тепловая машина – это некоторое периодически действующее устройство, которое в круговом процессе (цикле) производит механическую работу за счет части тепла, отнятого у какого-либо тела. Коэффициент полезного действия (КПД) тепловой машины показывает, какая часть тепла 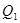 , полученного в круговом процессе от нагревателя (тела с более высокой температурой), превращается в механическую работу. Наибольшим КПД
, полученного в круговом процессе от нагревателя (тела с более высокой температурой), превращается в механическую работу. Наибольшим КПД  обладает обратимая тепловая машина Карно, работающая по циклу Карно.
обладает обратимая тепловая машина Карно, работающая по циклу Карно.
 (19)
(19)
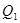 - теплота, полученная за цикл от тела с более высокой температурой
- теплота, полученная за цикл от тела с более высокой температурой 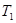 (нагревателя),
(нагревателя),
 - теплота, переданная телу с меньшей температурой
- теплота, переданная телу с меньшей температурой  (холодильнику),
(холодильнику),
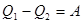 - работа за цикл.
- работа за цикл.
Из (19) следует:
 (20)
(20)
Отношение 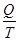 называется приведенной теплотой. Сумма приведенных теплот в цикле Карно равна нулю. Аналогичный результат получается при рассмотрении цикла Карно с бесконечно малыми изотермами, для которого разность температур – конечная величина, а теплоты, полученные или отданные рабочим телом в цикле бесконечно малы:
называется приведенной теплотой. Сумма приведенных теплот в цикле Карно равна нулю. Аналогичный результат получается при рассмотрении цикла Карно с бесконечно малыми изотермами, для которого разность температур – конечная величина, а теплоты, полученные или отданные рабочим телом в цикле бесконечно малы:
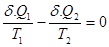 (21)
(21)
Любой обратимый цикл можно разбить на сумму бесконечно малых циклов Карно. Для каждого из бесконечно малых циклов Карно справедливо равенство (38). Следовательно  всех малых циклов равна нулю. В пределе для произвольного обратимого цикла (обратимого кругового процесса) сумма приведенных теплот равна нулю (выполняется равенство Клаузиуса):
всех малых циклов равна нулю. В пределе для произвольного обратимого цикла (обратимого кругового процесса) сумма приведенных теплот равна нулю (выполняется равенство Клаузиуса):
Равенство Клаузиуса: 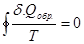 (22)
(22)
Из (22) следует существование у термодинамических систем функции состояния, изменение которой определяется приведенной теплотой. Эта функция состояния S введена Клаузиусом в 1865 г. и названа энтропией.
При необратимых круговых процессах сума приведенных теплот меньше нуля (выполняется неравенство Клаузиуса):
Неравенство Клаузиуса:  < 0 (23)
< 0 (23)
Процессы в изолированных системах. Изолированные системы не обмениваются массой и энергией с окружающей средой. Из первого закона термодинамики и вытекающих из него закономерностей обмена энергией между телами при различных процессах нельзя сделать вывод о возможности и направлении протекания некоторого процесса в изолированной системе. Между тем реальные процессы протекают в определенном направлении и, как правило, не изменив условий, нельзя заставить процесс пойти в обратном направлении. Реальные процессы протекают с конечной скоростью и являются неравновесными процессами. В результате течения таких процессов система приближается к равновесию. С наступлением равновесия процесс заканчивается. Очевидно, что все неравновесные процессы протекают в направлении достижения равновесия и протекают самопроизвольно (без воздействия внешней силы). Неравновесный процесс необратим. Второе начало термодинамики позволяет ввести в качестве критерия, позволяющего предсказать возможность самопроизвольного течения процесса в изолированной системе, изменение энтропии.
В изолированных системах U=const, V=const;  = 0. Следовательно:
= 0. Следовательно:
1) для необратимых, неравновесных процессов:
 >
>  ;
; 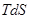 >
>  ;
; 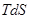 > 0;
> 0;  >0;
>0;  > 0 (24)
> 0 (24)
2) для обратимых квазистатических процессов:
 ;
; 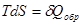 ;
; 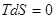 ;
; 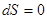 ; DSU,V= 0 (25)
; DSU,V= 0 (25)
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 703; Нарушение авторских прав?; Мы поможем в написании вашей работы!