
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Смешение идеальных газов при постоянных температуре и давлении
|
|
|
|
Изотермическое сжатие или расширение идеального газа.
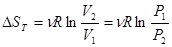 (30)
(30)
Если n1 молей одного газа, занимающего объем V 1, смешиваются с n2 молями другого газа, занимающего объем V 2, то общий объем газовой смеси будет равен (V 1 + V 2 ). Изменение энтропии в рассматриваемом процессе равно сумме изменений энтропии каждого газа при изменении его объема от первоначального значения до(V 1 + V 2 ):
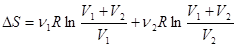 =
= 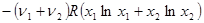 (31)
(31)
 - мольная доля i -го газа в полученной газовой смеси. Изменение энтропии при смешении газов всегда положительно, так как все ln xi < 0, поэтому идеальные газы всегда смешиваются необратимо. Если при тех же условиях смешиваются два разных объема одного и того же газа, то уравнение (48) уже неприменимо. Никаких изменений в системе при таком смешении не происходит, и
- мольная доля i -го газа в полученной газовой смеси. Изменение энтропии при смешении газов всегда положительно, так как все ln xi < 0, поэтому идеальные газы всегда смешиваются необратимо. Если при тех же условиях смешиваются два разных объема одного и того же газа, то уравнение (48) уже неприменимо. Никаких изменений в системе при таком смешении не происходит, и  S = 0. Тем не менее, формула (48) не содержит никаких индивидуальных параметров газов, поэтому, казалось бы, должна быть применима и к смешению одинаковых газов. Это противоречие называют парадоксом Гиббса.
S = 0. Тем не менее, формула (48) не содержит никаких индивидуальных параметров газов, поэтому, казалось бы, должна быть применима и к смешению одинаковых газов. Это противоречие называют парадоксом Гиббса.
5) Постулат Планка. Абсолютные значения энтропии.
Для энтропии характерна шкала абсолютных значений, в основе которой лежит тепловая теорема Нернста и постулат Планка (третий закон термодинамики). Тепловая теорема Нернста: вблизи абсолютного нуля температур все процессы протекают без изменения энтропии.
Постулат Планка: энтропия идеального кристаллического вещества равна нулю при абсолютном нуле температур  .
.
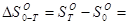
 (32)
(32)
 - абсолютная энтропия некоторого вещества при температуре Т (стандартное значение).
- абсолютная энтропия некоторого вещества при температуре Т (стандартное значение).
Для расчета абсолютной энтропии веществ в стандартном состоянии надо знать зависимости теплоемкости Cp от температуры для каждой из фаз, а также температуры и энтальпии фазовых переходов. Так, например, абсолютная энтропия газообразного вещества в стандартном состоянии при температуре T складывается из следующих составляющих:
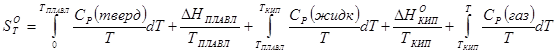 (33)
(33)
В термодинамических таблицах приводят значения абсолютных энтропий веществ в стандартном состоянии при температуре 298 К.
6) Изменения энтропии при химических реакциях.
Значения абсолютной энтропии веществ используют для расчета изменения энтропии в химических реакциях. Изменение энтропии при химической реакции равно разности абсолютных значений энтропий продуктов реакции (i) и исходных веществ (j) с учетом стехиоетрических коэффициентов.
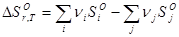 (34)
(34)
Пример 4. Вычислить изменение энтропии для реакции С2Н2 + 2 Н2 = С2Н6 в стандарт
ных условиях при температуре 298 К.
Решение: В справочнике находим значения абсолютных энтропий участников реакции при температуре 298 К:
С2Н2 Н2 С2Н6
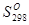 кал/моль К 48,00 31,21 54,85
кал/моль К 48,00 31,21 54,85
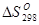 =
= 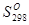 (С2Н6) -
(С2Н6) - 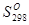 (С2Н2) - 2
(С2Н2) - 2 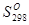 (Н2)
(Н2)
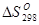 = 4,85 – 48,00 - 2×31,21 = - 5,7 кал/моль К
= 4,85 – 48,00 - 2×31,21 = - 5,7 кал/моль К
Физический смысл энтропии.
Вариант 1 (термодинамический). Из термодинамического определения энтропии следует равенство 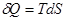 . Выражение
. Выражение 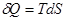 позволяет сделать вывод, что процесс выравнивания температуры системы (фактора интенсивности) должен сопровождаться изменением фактора емкости, роль которого выполняет энтропия.
позволяет сделать вывод, что процесс выравнивания температуры системы (фактора интенсивности) должен сопровождаться изменением фактора емкости, роль которого выполняет энтропия.
Вариант 2 (молекулярно-кинетический). Энтропия – мера беспорядочности движения молекул. Энтропия возрастает при увеличении «беспорядочности», хаотичности движения молекул (при нагревании, плавлении, испарении вещества, увеличении объема газов).
Вариант 3 (статистический). Статистическое определение энтропии основано на идее о том, что необратимые процессы в термодинамике вызваны переходом в более вероятное состояние, поэтому энтропию можно связать с термодинамической вероятностью состояния систем. Термодинамическая вероятность состояния систем W определяет число микросостояний, которыми может быть реализовано данное макросостояние системы. Если, например, система объема V состоит из двух равных по объему частей, содержит в целом N молекул, которые так распределены в системе, что в одной половине сосуда находится N1 молекул, в другой половине сосуда находится N2 = N – N1 молекул, то число микросостояний (возможных распределений «разных» молекул), которыми реализуется такое распределение – макросостояние, определяется по формуле:
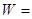 N!/ N1! × (N – N1)! (35)
N!/ N1! × (N – N1)! (35)
Наибольшим числом способов реализуется равномерное распределение молекул в системе, которое соответствует равновесному состоянию. Этот вывод справедлив для систем, состоящих из большого числа частиц. Максимум энтропии также соответствует равновесному состоянию системы. Связь между энтропией и термодинамической вероятностью состояния систем была установлена Больцаном:
Формула Больцмана: 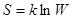 (36)
(36)
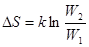 (37)
(37)
где k = 1.38  10-23 Дж/К - постоянная Больцмана (k = R / N A), W - термодинамическая вероятность состояния системы, т.е. число микросостояний, которые соответствуют данному макросостоянию системы.
10-23 Дж/К - постоянная Больцмана (k = R / N A), W - термодинамическая вероятность состояния системы, т.е. число микросостояний, которые соответствуют данному макросостоянию системы.
Наибольшее значение W соответствует равновесному состоянию системы. Соотношение (54) показывает, что возрастание энтропии соответствует переходу системы к состоянию с большей термодинамической вероятностью.
В реальных макросистемах небольшие отклонения от равномерного распределения частиц имеют место и происходят очень часто. Такие отклонения называют флуктуациями. Флуктуации - самопроизвольные процессы, отдаляющие систему от равновесия. С позиции второго начала термодинамики процессы, отдаляющие систему от равновесия, не могут протекать самопроизвольно. Следовательно, второе начало термодинамики не является всеобщим законом природы. Оно выполняется с высокой точностью только для систем, состоящих из большого числа частиц, т.е. является законом статистическим.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 1297; Нарушение авторских прав?; Мы поможем в написании вашей работы!