
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кальций
|
|
|
|
Калий
Натрий
Материально-техническое обеспечение дисциплины.
Дополнительная литература
Основная литература
Дисциплины
Учебно-методическое и информационное обеспечение
Хаханина Т. И. Химия окружающей среды [Электронный ресурс]: учебное пособие - М.: ЮРАЙТ, 2010. – 129 с. //Университетская библиотека online: сайт. - Режим доступа: http://www.biblioclub.ru
1. Тарасова, Наталия Павловна. Химия окружающей среды: атмосфера: учеб. пособие для студ. вузов / Н. П. Тарасова, В. А. Кузнецов. - М.: Академия, 2007. - 227 с. Есипов, Юрий Вениаминович.
Мониторинг и оценка риска систем "защита-объект-среда" / Ю. В. Есипов, Ф. А. Самсонов, А. И. Черемисин; РАН, Юж. науч. центр. - М.: URSS, 2008. - 136 с.
2. Ларионов Н. М. Промышленная экология. [Электронный ресурс]: Учебник для бакалавров - М.: ЮРАЙТ, 2012. – 496 с. // Университетская библиотека online: сайт. - Режим доступа: http://www.biblioclub.ru
Для выполнения рабочей программы дисциплины «Химия биосферы» кафедра располагает материально-технической базой, обеспечивающей проведение всех видов подготовки, практической и научно-исследовательской работы обучающихся, соответствующим действующим санитарным и противопожарным правилам и нормам. Интерактивные занятия проводятся в аудиториях, оборудованных мультимедийной аппаратурой и доступом к Интернет.
Натрий – элемент 3‑го периода и IA‑группы Периодической системы, порядковый номер 11. Электронная формула атома [10Ne]3s1, степени окисления +I и 0. Имеет малую электроотрицательность (0,93), проявляет только металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли натрия хорошо растворимы в воде.
В природе – пятый по химической распространенности элемент (второй среди металлов), встречается только в виде соединений. Жизненно важный элемент для всех организмов.
Натрий, катион натрия и его соединения окрашивают пламя газовой горелки в ярко‑желтый цвет (качественное обнаружение).
Натрий Na. Серебристо‑белый металл, легкий, мягкий (режется ножом), низкоплавкий. Хранят натрий в керосине. С ртутью образует жидкий сплав – амальгаму (до 0,2 % Na).
Весьма реакционноспособный, во влажном воздухе натрий медленно покрывается гидроксидной пленкой и теряет блеск (тускнеет):

Натрий химически активен, сильный восстановитель. Воспламеняется на воздухе при умеренном нагревании (>250 °C), реагирует с неметаллами:
2Na + O2 = Na2O2 2Na + H2 = 2NaH
2Na + Cl2 = 2NaCl 2Na + S = Na2S
6Na + N2 = 2Na3N 2Na + 2C = Na2C2
Очень бурно и с большим экзо ‑эффектом натрий реагирует с водой:
2Na + 2H2O = 2NaOH + Н2↑ + 368 кДж
От теплоты реакции кусочки натрия расплавляются в шарики, которые начинают беспорядочно двигаться из‑за выделения Н2. Реакция сопровождается резкими щелчками вследствие взрывов гремучего газа (Н2 + O2). Раствор окрашивается фенолфталеином в малиновый цвет (щелочная среда).
В ряду напряжений натрий стоит значительно левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород (за счет Н2O и Н+).
Получение натрия в промышленности:

(см. также ниже получение NaOH).
Натрий применяется для получения Na2O2, NaOH, NaH, а также в органическом синтезе. Расплавленный натрий служит теплоносителем в ядерных реакторах, а газообразный – используется как наполнитель желтосветных ламп наружного освещения.
Оксид натрия Na2O. Основный оксид. Белый, имеет ионное строение (Na+)2O2‑. Термически устойчивый, при прокаливании медленно разлагается, плавится под избыточным давлением пара Na. Чувствителен к влаге и углекислому газу в воздухе. Энергично реагирует с водой (образуется сильнощелочной раствор), кислотами, кислотными и амфотерными оксидами, кислородом (под давлением). Применяется для синтеза солей натрия. Не образуется при сжигании натрия на воздухе.
Уравнения важнейших реакций:

Получение: термическое разложение Na2O2 (см.), а также сплавление Na и NaOH, Na и Na2O2:
2Na + 2NaOH = 2NaaO + H2 (600 °C)
2Na + Na2O2 = 2NaaO (130–200 °C)
Пероксид натрия Na2O2. Бинарное соединение. Белый, гигроскопичный. Имеет ионное строение (Na+)2O22‑. При нагревании разлагается, плавится под избыточным давлением O2. Поглощает углекислый газ из воздуха. Полностью разлагается водой, кислотами (выделение O2 при кипячении – качественная реакция на пероксиды). Сильный окислитель, слабый восстановитель. Применяется для регенерации кислорода в изолирующих дыхательных приборах (реакция с СO2), как компонент отбеливателей ткани и бумаги. Уравнения важнейших реакций:
2Na2O2 = 2Na2O + O2 (400–675 °C, вакуум)
Na2O2 + 2Н2O = Н2O2 + 2NaOH (на холоду)
2Na2O2 + 2Н2O = O2↑ + 4NaOH (кипячение)
Na2O2 + 2НCl (разб.) = 2NaCl + Н2O2 (на холоду)
2Na2O2 + 4НCl (разб.) = 4НCl + 2Н2O + O2↑ (кипячение)
2Na2O2 + 2CO2 = Na2CO3 + O2
Na2O2 + CO = Na2CO3
Na2O2 + 4H+ + 2I‑ = I2↓ + 2H2O + 2Na+
5Na2O2 + 16H+ + 2MnO4‑ = 5O2↑ + 2Mn2+ + 8H2O + 10Na+
3Na2O2 + 2[Cr(OH)6]3‑ = 2CrO24‑ + 8OH‑ + 2H2O + 6Na+ (80 °C)
Получение: сжигание Na на воздухе.
Гидроксид натрия NaOH. Основный гидроксид, щелочь, техническое название едкий натр. Белые кристаллы с ионным строением (Na+)(OH‑). Расплывается на воздухе, поглощая влагу и углекислый газ (образуется NaHCO3). Плавится и кипит без разложения. Вызывает тяжелые ожоги кожи и глаз.
Хорошо растворим в воде (с экзо ‑эффектом, +56 кДж). Реагирует с кислотными оксидами, нейтрализует кислоты, вызывает кислотную функцию у амфотерных оксидов и гидроксидов:
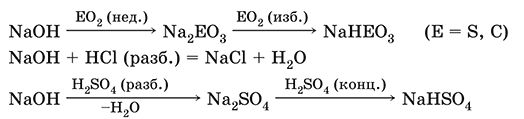
NaOH (разб.) + H3PO4 (конц.) = NaH2PO4 + H2O
2NaOH (разб.) + H3PO4 (разб.) = Na2HPO4 + 2H2O
3NaOH (конц.) + H3PO4 (разб.) = Na3PO4 + 3H2O
2NaOH(T) + M2O3 = 2NaMO2 + H2O (1000 °C, M = Al, Cr)
2NaOH (конц.) + 3H2O + AI2O3 = 2Na[Al(OH)4] (кипячение)
2NaOH(T) + M(OH)2 = Na2MO2 + 2H2O (500 °C, M = Be, Zn)
2NaOH (конц.) + Zn(OH)2 = Na2[Zn(OH)4]
Осаждает нерастворимые гидроксиды:
2NaOH + MCl2 = 2NaCl + M(OH)2↓ (M = Mg, Cu)
Подвергает дисмутации галогены и серу:
2NaOH (конц., хол.) + Е2 = NaE + NaEO + H2O (Е = Cl, Br)
6NaOH (разб., гор.) + 3S = 2Na2S + Na2SO3 + 3H2O
Подвергается электролизу в расплаве:

Раствор NaOH разъедает стекло (образуется NaSiO3), корродирует поверхность алюминия (образуются Na[Al(OH)4] и Н2).
Получение NaOH в промышленности:
а) электролиз раствора NaCl на инертном катоде:

б) электролиз раствора NaCl на ртутном катоде (амальгамный способ):

(освобождающуюся ртуть возвращают в электролизер).
Едкий натр – важнейшее сырье химической промышленности. Используется для получения солей натрия, целлюлозы, мыла, красителей и искусственного волокна; как осушитель газов; реагент в извлечении из вторичного сырья и очистке олова и цинка; при переработке руд алюминия (бокситов).
Калий – элемент 4‑го периода и IA‑группы Периодической системы, порядковый номер 19. Электронная формула атома [18Ar]4s1, степени окисления +I и 0. Имеет малую электроотрицательность (0,91), проявляет металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли калия хорошо растворимы в воде.
В природе – девятый по химической распространенности элемент (шестой среди металлов), находится только в виде соединений. Жизненно важный элемент для всех организмов.
Недостаток калия в почве восполняется внесением калийных удобрений – хлорида КCl, сульфата K2SO4 и золы растений.
Калий, катион калия и его соединения окрашивают пламя газовой горелки в фиолетовый цвет (качественное обнаружение).
Калий К. Серебристо‑белый металл, легкий, очень мягкий, низкоплавкий. Хранят калий под слоем керосина. С ртутью образует жидкий сплав – амальгаму.
По химическим свойствам похож на натрий, но еще более реакционноспособный. Во влажном воздухе тускнеет, покрываясь гидроксидной пленкой.
Калий проявляет сильные восстановительные свойства. Активно сгорает на воздухе до КO2, реагирует с водородом (продукт KH), хлором (КCl), серой (K2S).
Энергично и с высоким экзо ‑эффектом калий разлагает воду:
2К + 2H2O = 2KOH + Н2↑ + 392 кДж,
выделяющийся водород тут же воспламеняется.
В ряду напряжений калий стоит значительно левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород (за счет Н2O и Н+), при этом серная кислота частично восстанавливается до SO2.
Получение калия в промышленности одинаково с получением натрия.
Применяется калий для синтеза его соединений (КO2, KH, соли), в виде расплава (в смеси с Na) – как теплоноситель в ядерных реакторах.
Гидроксид калия КОН. Основный гидроксид, щёлочь, техническое название едкое кали. Белый, имеет ионное строение К+ОН‑. Плавится и кипит без разложения. Расплывается на воздухе, поглощает углекислый газ (образуется КНСO3). Вызывает тяжелые ожоги кожи и глаз.
Хорошо растворим в воде (с высоким экзо ‑эффектом), создает в растворе сильнощелочную среду. Нейтрализуется кислотами, реагирует с кислотными оксидами, амфотерными гидроксидами и оксидами. Концентрированный раствор разъедает стекло (образуется K2SiO3).
Важнейшие реакции и методы получения КОН в промышленности аналогичны свойствам и получению NaOH.
Применяется КОН в производстве мыла, как адсорбент газов, дегидратирующий агент, осадитель нерастворимых гидроксидов металлов.
Кальций – элемент 4‑го периода и IIA‑группы Периодической системы, порядковый номер 2O. Электронная формула атома [18Ar]4s2, степени окисления +II и 0. Относится к щелочноземельным металлам.
Имеет низкую электроотрицательность (1,04), проявляет металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Многие соли кальция малорастворимы в воде.
В природе – шестой по химической распространенности элемент (третий среди металлов), находится в связанном виде. Жизненно важный элемент для всех организмов.
Недостаток кальция в почве восполняется внесением известковых удобрений (СаСO3, СаО, цианамид кальция CaCN2 и др.).
Кальций, катион кальция и его соединения окрашивают пламя газовой горелки в темно‑оранжевый цвет (качественное обнаружение).
Кальций Са. Серебристо‑белый металл, мягкий, пластичный. Во влажном воздухе тускнеет и покрывается пленкой из СаО и Са(ОН)2.
Весьма реакционноспособный; воспламеняется при нагревании на воздухе, реагирует с водородом, хлором, серой и графитом:
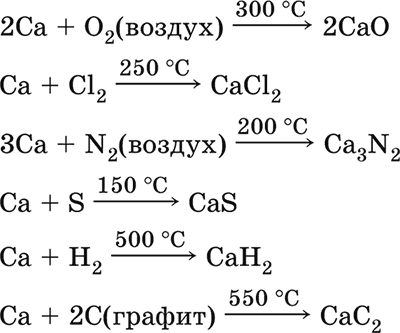
Восстанавливает другие металлы из их оксидов (промышленно важный метод – кальцийтержия):
ЗСа + Cr2O3 = ЗСаО + 2Cr (700–800 °C)
5Са + V2O5 = 5СаО + 2V (950 °C)
Энергично реагирует с водой (с высоким экзо ‑эффектом):
Са + 2Н2O = Са(ОН)2 + Н2↑ + 413 кДж
В ряду напряжений стоит значительно левее водорода, из разбавленных кислот НCl и H2SO4 вытесняет водород (за счет Н2O и Н+):
Ca + 2H+ = Са2+ + Н2↑
Получение кальция в промышленности:

Кальций применяется для удаления примесей неметаллов из металлических сплавов, как компонент легких и антифрикционных сплавов, для выделения редких металлов из их оксидов.
Оксид кальция СаО. Основный оксид. Техническое название негашёная известь. Белый, весьма гигроскопичный. Имеет ионное строение Са2+O2‑. Тугоплавкий, термически устойчивый, летучий при прокаливании. Поглощает влагу и углекислый газ из воздуха. Энергично реагирует с водой (с высоким экзо ‑эффектом), образует сильно щелочной раствор (возможен осадок гидроксида), процесс называется гашение извести. Реагирует с кислотами, оксидами металлов и неметаллов. Применяется для синтеза других соединений кальция, в производстве Са(ОН)2, СаС2 и минеральных удобрений, как флюс в металлургии, катализатор в органическом синтезе, компонент вяжущих материалов в строительстве.
Уравнения важнейших реакций:

Получение СаО в промышленности – обжиг известняка (900–1200 °C):
СаСO3 = СаО + СO2
Гидроксид кальция Са(ОН)2. Основный гидроксид. Техническое название гашёная известь. Белый, гигроскопичный. Имеет ионное строение Са2+(ОН‑)2. Разлагается при умеренном нагревании. Поглощает влагу и углекислый газ из воздуха. Малорастворим в холодной воде (образуется щелочной раствор), еще меньше – в кипящей воде. Прозрачный раствор (известковая вода) быстро мутнеет из‑за выпадения осадка гидроксида (суспензию называют известковое молоко). Качественная реакция на ион Са2+ – пропускание углекислого газа через известковую воду с появлением осадка СаСO3 и переходом его в раствор. Реагирует с кислотами и кислотными оксидами, вступает в реакции ионного обмена.
Применяется в производстве стекла, белильной извести, известковых минеральных удобрений, для каустификации соды и умягчения пресной воды, а также для приготовления известковых строительных растворов – тестообразных смесей (песок + гашёная известь + вода), служащих связующим материалом для каменной и кирпичной кладки, отделки (оштукатуривания) стен и других строительных целей. Отвердевание («схватывание») таких растворов обусловлено поглощением углекислого газа из воздуха.
Уравнения важнейших реакций:
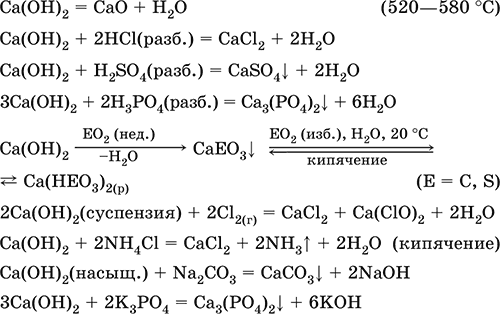
Получение Са(ОН)2 в промышленности – гашение извести СаО (см. выше).
5.4. Жёсткость воды
Природная вода, проходя через известковые горные породы и почвы, обогащается солями кальция и магния (а также железа) и становится жёсткой. В жесткой воде при стирке белья увеличивается расход мыла, а ткань, впитывая соли, становится желтой и быстро ветшает. Накипь – нерастворимые соединения кальция и магния и оксид железами), осаждающиеся на внутренних стенках посуды, паровых котлов и трубопроводов. В жесткой воде дольше варятся овощи, крупы и мясо. Различают временную и постоянную жесткость воды.
Временная жесткость вызвана присутствием в воде гидрокарбонатов М(НСO3)2 (М = Са, Mg) и Fe(HCO3)2. Если количественно определяют содержание ионов HCO3‑, говорят о карбонатной жесткости, если содержание ионов Са2+, Mg2+ и Fe2+ – о кальциевой, магниевой или железной жесткости. Временная жесткость тем выше, чем больше содержание этих ионов в воде. Жесткость воды назвали временной потому, что она устраняется простым кипячением:
Са(НСO3)2 = СаСO3↓ + Н2O + СO2↑
Mg(HCO3)2 = Mg(OH)2↓ + 2СO2↑
4Fe(HCO3)2 + O2 = 2Fe2O3↓ + 8CO2↑ + 4H2O
Постоянная жесткость обусловлена другими солями кальция и магния (сульфаты, хлориды, нитраты, дигидро‑ортофосфаты и др.). Такая жесткость не устраняется кипячением воды. Поэтому для удаления из жесткой воды большей части всех солей ее умягчают, используя химические реактивы и специальные (ионообменные) способы. Умягченная вода пригодна для питья и приготовления пищи.
Умягчение воды достигается, если ее обработать различными осадителями – гашеной известью, содой и ортофосфатом натрия:
устранение временной жесткости:
Са(НСO3)2 + Са(ОН)2 = 2СаСO3↓ + 2Н2O
Mg(HCO3)2 + Ca(OH)2 = CaMg(CO3)2↓ + 2Н2O
4Fe(HCO3)2 + 8Са(ОН)2 + O2 = 4FeO(OH)↓ + 8СаСO3↓ + 10Н2O
устранение постоянной жесткости:
Ca(NO3)2 + Na2CO3 = СаСO3↓ + 2NaNO3
2MgSO4 + Н2O = Na2CO3 = Mg2CO3(OH)2↓ + СO2↑ + 2Na2SO4
3FeCl2 + 2Na3PO4 = Fe3(PO4)2↓ + 6NaCl
В химической лаборатории и в промышленности используется полностью обессоленная вода (для питья она непригодна). Для получения обессоленной воды природную воду подвергают перегонке (дистилляции). Такая дистиллированная вода является мягкой, подобно дождевой воде.
|
|
|
|
|
Дата добавления: 2015-06-27; Просмотров: 740; Нарушение авторских прав?; Мы поможем в написании вашей работы!