
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Источники и механизм образования
|
|
|
|
Диоксид углерода
Основные загрязнители воздуха
По оценкам немецких ученых [[3]] природный объем поступления СО2 в атмосферу составляет 600000 млн.т/год, в то время как антропогенный – 22000 млн.т/год. Атмосферный СО2 находится в состоянии постоянного обмена с почвой, водами и живыми организмами (см. цикл углерода). Природный CO2 образуется в результате вулканической деятельности, выветривании горных пород, дыхании животных и растений, лесных пожаров и окислении гумуса почвы. Антропогенный СО2 образуется при полном окислении углеродсодержащего топлива – угля, нефтепродуктов, газа, древесины. В качестве примера разберем процесс образования СО2 в двигателях внутреннего сгорания (ДВС).
Процесс сгорания топлива в ДВС протекает очень быстро. Реакции сгорания углеводородов в камере сгорания двигателя являются весьма сложными и при этом недостаточно изученными. Известно, что реакции сгорания углеводородов относятся к типу цепных реакций с разветвлениями, при которых большое значение имеют цепи, образуемые от основной цепи. Характер протекания реакций зависит от температуры и давления в камере сгорания, от способа образования рабочей смеси и способа ее воспламенения.
Химическая реакция полного сгорания углеводородов может быть выражена стехиометрическим уравнением:
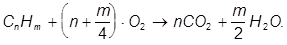
Данное уравнение было бы верным только в случае, если бы молекула топлива подверглась одновременному столкновению с  молекулами кислорода с соответствующей большой энергией. Вероятность такого столкновения настолько мала, что вообще не может приниматься во внимание. В соответствии с теорией цепной реакции, в период химической подготовки топлива к воспламенению некоторые молекулы углеводородов подвергаются распаду и при этом выделяются весьма активные (и неустойчивые) радикалы воспламенения, которые, взаимодействуя с молекулами кислорода, образуют органические перекиси и альдегиды. В момент, когда концентрация этих продуктов реакции достигает критической величины, происходит их взрывной распад и начинается цепь реакций сгорания.
молекулами кислорода с соответствующей большой энергией. Вероятность такого столкновения настолько мала, что вообще не может приниматься во внимание. В соответствии с теорией цепной реакции, в период химической подготовки топлива к воспламенению некоторые молекулы углеводородов подвергаются распаду и при этом выделяются весьма активные (и неустойчивые) радикалы воспламенения, которые, взаимодействуя с молекулами кислорода, образуют органические перекиси и альдегиды. В момент, когда концентрация этих продуктов реакции достигает критической величины, происходит их взрывной распад и начинается цепь реакций сгорания.
В момент перед возникновением пламени наблюдается резкий прирост ацетилена (C2H2) и H2. Одновременно накапливаются соединения CO, CO2, H2O и углерод. После воспламенения образуется монооксид углерода, ненасыщенные углеводороды и углерод. Дальнейшие преобразования этих компонентов, конечными продуктами которых являются CO2 и H2O, зависят от продолжительности реакции и газодинамических условий в камере сгорания [[4]]. В силу ряда обстоятельств, процесс сгорания топлива в ДВС всегда сопровождается образованием незначительного количества продуктов неполного окисления.
Максимально возможная концентрация CO2 в сухих продуктах сгорания различных горючих материалов зависит прежде всего от их элементарного состава, а не от эффективности процесса, и оценивается по формуле [[5]]:
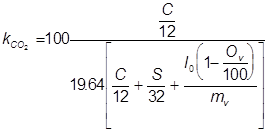 , (г/м3) , (г/м3)
| (1) |
где C, S, - элементарный состав топлива, % массы; Ov - объемная концентрация кислорода в воздухе, Ov=20.95%; mv - средняя молекулярная масса воздуха, mv= Ov/(25+28); l0 - стехиометрический коэффициент.
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 317; Нарушение авторских прав?; Мы поможем в написании вашей работы!