
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Источники и механизм образования
Монооксид углерода
Влияние на биосферу
Попавший в атмосферу CO2 остается в ней в среднем 2 – 4 года. За это время он распространяется по всей земной поверхности, входя в состав атмосферы. Влияние CO2 выражается не столько в токсическом действии на живые организмы, как в способности поглощать инфракрасные лучи. Более подробно последствия этого эффекта будут рассмотрены далее в специальной главе.
Монооксид углерода (СО) или угарныйгаз образуется в природе в результате вулканической деятельности, пожаров и окислении метана, который в свою очередь является результатом микробиологических процессов окисления органики. Суммарное ежегодное поступление природного СО в атмосферу оценивается в 3800 млн.т. [3]. К естественным источникам поступления СО добавляются антропогенные выбросы (500 млн.т/год), которые в первую очередь связаны с автотранспортом. Монооксид углерода является продуктом неполного сгорания углеводородного топлива в ДВС.
Стехиометрическое (теоретически необходимое) количество сухого воздуха (кг), необходимое для полного окисления 1 кг топлива можно рассчитать по формуле*:
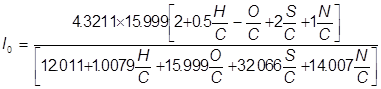 , ,
| (2) |
где H, C, O, S, N - элементарный состав топлива, % массы. Когда действительное воздухо-топливное соотношение смеси, поступающей в ДВС выше стехиометрического, то такая смесь обладает избытком воздуха и называется "бедной". Наоборот, когда действительное соотношение ниже стехиометрического, сгорание топлива неполное и смесь "богатая". В этом случае в ОГ будут содержаться продукты неполного сгорания, основным из которых является CO. Однако даже при сгорании бедных смесей со значительным избытком воздуха (в дизелях) вследствие локальных различий в составе смеси образуется СО. Тем не менее, в концентрация СО в отработавших газах дизелей на порядок меньше, чем у бензиновых ДВС.
Наиболее вероятными реакциями образования СО в камере сгорания являются следующие:
С + Н2О ® СО + Н2, С + СО2 ® 2СО.
Указанные реакции протекают в восстановительных зонах - у стенок камеры сгорания, на периферии факела, в зазорах между поршнем и цилиндром.
Поскольку СО – продукт неполного сгорания топлива, увеличению его эмиссии способствует работа на богатых смесях, низкая температура окружающей среды, образование отложений на деталях двигателя и топливной системы. При холодном пуске ДВС образование СО идет в 2 – 5 раз интенсивней, чем при работе прогретого двигателя [6].
|
|
Дата добавления: 2015-06-28; Просмотров: 291; Нарушение авторских прав?; Мы поможем в написании вашей работы!